휘발성 질소화합물 감응형 색변환 센서를 활용한 연어 신선도 모니터링
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
A colorimetric paper sensor was used to detect volatile nitrogen-containing compounds emitted from spoiled salmon filets to determine their freshness. The sensing mechanism was based on acid-base reactions between acidic pH-indicating dyes and basic volatile ammonia and amines. A sensing layer was simply fabricated by drop-casting a dye solution of bromocresol green (BCG) on a polyvinylidene fluoride substrate, and its color-change response was enhanced by optimizing the amounts of additive chemicals, such as polyethylene glycol, p-toluene sulfonic acid, and graphene oxide in the dye solution. To avoid the adverse effects of water vapor, both faces of the sensing layer were enclosed by using a polyethylene terephthalate film and a gas-permeable microporous polytetrafluoroethylene sheet, respectively. When exposed to basic gas analytes, the paper-like sensor distinctly exhibited a color change from initially yellow, then to green, and finally to blue due to the deprotonation of BCG via the Brønsted acid-base reaction. The use of ammonia analyte as a test gas confirmed that the sensing performance of the optimized sensor was reversible and excellent (detection time of < 15 min, sensitive naked-eye detection at 0.25 ppm, good selectivity to common volatile organic gases, and good stability against thermal stress). Finally, the coloration intensity of the sensor was quantified as a function of the storage time of the salmon filet at 28°C to evaluate its usefulness in monitoring of the food freshness with the measurement of the total viable count (TVC) of microorganisms in the food. The TVC value increased from 3.2 × 105 to 3.1 × 109 cfu/g in 28 h and then became stable, whereas the sensor response abruptly changed in the first 8 h and slightly increased thereafter. This result suggests that the colorimetric response could be used as an indicator for evaluating the degree of decay of salmon induced by microorganisms.
Keywords:
Colorimetric sensor, food sensor, freshness monitoring, BCG, Total volatile basic nitrogen (TVBN)1. 서 론
음식물 유통량이 꾸준히 증가하면서, 음식물 상태를 실시간으로 확인할 수 있는 기술에 대한 필요성이 크게 대두되고 있다. 음식물은 보관 상태 혹은 보관 기간에 따라서 품질이 저하되고, 특히 유해 미생물에 오염된 음식을 섭취할 경우에 복통 및 식중독 등의 증상을 겪을 수 있다[1]. 현재 한국 식품의약품안전처에서는 다양한 식품류에 대한 미생물의 최대 허용 한계치를 지정하고 있지만, 여름철에 식중독 사고를 빈번하게 일으키는 수산 생물에 대한 기준은 미비한 실정이다. 또한 음식물은 구매 후에 상당한 시간이 경과한 후에 요리하므로 지속적인 음식물 상태를 모니터링 할 수 있는 모니터링 기술이 필요하다.
미생물 개체 수를 측정하는 대표적인 방법으로는 현미경 직접 계수법과 생균수 측정법 등이 있다[2,3]. 현미경 직접 계수법은 빠른 측정이 가능하고 많은 재료가 필요하지 않다는 장점이 있지만, 일반인이 수행하기에는 어렵다는 단점이 있다. 반면에 생균수 측정법의 경우, 장시간 배양이 필요하여 실시간 현장 검사는 불가능하다는 단점이 있다. 이러한 문제점을 극복할 수 있는 다른 수단으로 휘발성 질소화합물(total volatile basic nitrogen, TVBN)을 감지하는 방법이 있다. 이는 부패가 진행되면 미생물 개체 수가 증가하고, 이들이 음식물의 단백질을 분해하여 TVBN을 발생시키는 것을 이용한 간접 측정 방법이다[4]. TVBN농도를 측정하는 방법으로 가스 크로마토그래피처럼 기자재를 사용하는 기기 분석법, 전기화학 또는 색변환 센서 기술 등이 있다[5,6]. 분석 기기를 이용하는 방법은 측정 신뢰성이 높다는 장점이 있지만, 고가의 기자재와 분석 전문가가 필요하다는 단점이 있다. 전기화학 센서와 비교하여, 색변환 센서의 경우에 리트머스 종이처럼 육안을 이용하여 인지가 가능하므로 구조가 단순하고, 낮은 가격으로 소형의 센서를 구현할 수 있다는 장점을 가진다[7]. 비록 색변환 센서 기술은 정량화된 수치를 제공하는 측면에서는 성능이 떨어지지만, 일반인이 간단히 음식물의 품질을 판단하는 용도로 사용 가능한 유망한 기술이다.
본 연구에서는 연어 고기 시료를 이용하여 보관 시간 및 조건에 따른 색변환 센서의 감지 세기를 고찰하였다. 색변환 센서는 pH 지시약인 브로모크레졸그린(BCG) 염료를 이용하여 염기성 TVBN에 의해 노란색에서 청색으로 변하는 특성을 활용하였다[8-10]. 먼저 최적의 색변환 센서를 제작하기 위하여 염료 용액에 다양한 첨가제를 추가하여 센서를 제조한 이후에 암모니아 감지 성능을 평가하였다. 또한 색변환 감지 세기와 미생물 총 개체수(total viable count, TVC)사이의 연관성을 확인하기 위하여, 연어에 존재하는 TVC 수치를 생균수 측정법으로 확인하였다[11].
2. 실험 방법
2.1. 사용 시약 및 장비
BCG 염료는 대정화금에서 구입하였고, 옥살산(OA), 폴리에틸렌 글라이콜(PEG), 그래핀 옥사이드(GO; Ludox), 파라톨루엔술포닉산(TA)는 시그마-알드리치 사에서 구입하였다. 센서 기판으로는 폴리플루오린화비닐리덴 시트(PVDF; PVDF2025A, Scilab)을 사용하였다. 센서 제작에는 다공성 polytetrafluoroethylene(PTFE; PM28Y, Porex), 투명 polyethylene terephthalate 필름(PET; SKC) 및 라미네이션 필름 소재와 레이저 조각기(VLS2.30, Universal) 및 사무용 라미레이터 기기를 사용하였다.
음식물 실험을 위하여 마트에서 연어 고기를 구입하여 균질기로 분쇄한 이후에 실험에 사용하였다. 미생물 배양은 standard plate count agar 배지(Oxoid CM463, Hampshire)를 사용하였고, 센서의 색상은 DSLR 카메라(Nikon D5100) 또는 스캐너(Scanjet G3110, HP)를 이용하여 관측하였다.
2.2. 센서 제작
전형적으로 에탄올 0.5 mL에 4.2 mg BCG, 5.7 mg TA, 7.5 μL PEG를 녹인 용액 #1과 증류수 1.5 mL에 20 μg GO를 분산시켜 용액 #2를 제조하였다. 제조된 용액 #1과 용액 #2를 혼합한 이후에 볼텍스 믹서를 이용하여 균일하게 분산시켜 이를 감지막 제작용 혼합용액으로 사용하였다.
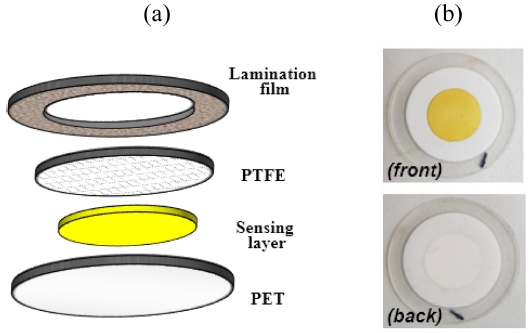
감지막은 원형의 8 mm PVDF시트 위에 25μL 혼합용액 를 드랍-캐스팅한 이후에 상온 및 60oC에서 각각 10분씩 2단계로 건조하여 제작하였다. 제작된 감지 시트를 Fig. 1a에 도식한 것처럼 PET 필름 (f = 22mm), 다공성 PTFE (f = 17mm) 및 도넛형 라미네이션 필름들을 정렬시킨 이후에 라미레이터 기기를 이용하여 센서를 제작하였다. Fig. 1b는 제작된 센서에 대한 사진을 보여준다.
최적의 센서를 제조하기 위하여 BCG 염료 용액에 PEG, 산성 유기화합물(OA 또는 TA), 추가 첨가물(GO)의 조성을 다양하게 변화시키면서 색변환 성능을 평가 하였다. 또한 다양한 고분자 시트(PVDF, 나일론, PAN, PTFE, 실리카겔 종이, 셀룰로오스 종이)를 센서 기판을 이용하여 성능 평가 실험을 수행하였다.
2.3. 표준 암모니아 가스를 이용한 센서 평가
제작된 감지막 또는 센서의 TVBN감지 특성을 평가하기 위하여 암모니아 가스를 표준 시료로 이용하여 색변환 실험을 수행하였다. 센서를 밀폐형 용기 내부에 고정시킨 이후에 NH3 시료와 공기의 상대 유량을 제어하여 측정 농도를 조절 하였고, 전체 유량은 1,000 sccm 조건에서 수행하였다. 스캐너 또는 카메라를 이용하여 컬러 사진을 획득하고, 얻어진 사진에서 RGB 색상 좌표를 추출하여 가스 시료 노출 전의 색상 좌표를 원점으로 하여 색상 변화 세기를 RGB 좌표에서의 거리(RGB 거리)로 정량화 하였다[12,13].
센서의 색 좌표는 습도에 영향을 받기 때문에, 이로 인한 오차를 최소화하고자 일정한 상대습도 조건(RH = 0, 50 or 100%)에서 색상 변화를 상온에서 관측하였다.
연어를 이용한 센서 실험은 28oC, RH = 100% 조건에서 수행하였고, 유사한 크기 갖는 3 g 연어 고기를 40 mL 유리 용기에 집어 넣은 이후에 뚜껑을 닫은 상태에서 실험을 수행하였다. 색변환 센서는 용기 뚜껑에 장착하여 외부 대기와 차단된 상태에서 내부 기체 성분은 투과하여 색상 변환을 유도되도록 하였고, 색상은 외부에서 직접 관측이 가능하도록 하였다[14-16]. 색상 관측은 미생물의 개체수가 중가하는 초기 48시간의 보관 시간에서 얻어진 시료 사진을 이용하여 위와 동일한 방법을 사용하여 색상 변화 세기를 정량화 하였다.
2.4. 미생물 개체 수 측정
센서를 이용하여 관측한 동일한 연어 시료를 이용하여 생균수 측정법을 이용하여 TVC를 확인하는 실험도 동시에 수행하였다. 이를 위하여 정해진 실험 조건에서 보관 시간을 다르게 하면서 동일한 양의 연어 고기를 채취하여 TVC 수치를 결정하였다. 채취된 고기 시료는 먼저 균질기를 이용하여 6,000 rpm에서 2분 동안 분쇄하고 이를 peptone 수용액으로 희석하여 용액 상태로 준비하였다. 연어 용액을 멸균 스프레더를 이용하여 standard plate count agar배지에 접종하고, 48시간동안 배양한 뒤에 colony forming unit(CFU)을 육안으로 계수하였다[17].
3. 결과 및 고찰
3.1. TVBN 색변환 센서 최적화
센서 기판은 염료를 고정시켜주는 역할을 하고, 감지 특성에도 영향을 끼친다. Table 1은 5종의 s.시트 소재에 대하여 다른 습도 조건, 암모니아 색변화 감지 및 회복 특성을 보여주는 센서 사진을 정리한 결과를 보여준다. 40 mg BCG, 50 mg OA, 75μL PEG를 20 mL 에탄올 용매에 녹인 25 μL 염료 용액을 이용하여 제작한 센서를 실험에 사용하였다. 습도에 대한 민감도를 확인하기 위해 상대 습도 50 및 100%에서 센서의 색상 변화를 관측하였다. 또한 염기성 분자에 대한 색변환 감지 및 회복 특성을 확인하기 위해서 RH = 50% 조건에서 10 ppm 암모니아에 5분 동안 노출한 상태와 연속해서 30분 동안 질소로 회복시킨 상태에서의 색상 변화를 관측하였다. 상대 습도가 증가하면 초기 노란색이 연노란색으로 변화하였고, 색변환 세기는 PVDF > silica gel paper, nylon> PAN nanofiber > 셀룰루스 종이 기판 순서였다. 이러한 색상 변화는 물 분자가 약한 염기로 작용하기 때문이라고 설명되고, 색상 변화 세기는 기판의 영향을 받는다는 것을 보여준다[18].
센서가 염기성 암모니아 가스에 노출되면 노란색이 청색으로 색상 변환을 일으켰고, 색변환 세기는 사용한 기판에 크게 의존함을 확인하였다. 이 중에서 PVDF 시트를 센서 기판으로 사용한 경우에 가장 강한 청색으로의 색상 변화를 보여 주었고, 이러한 색상 변화는 회복 기간에 거의 초기 색상으로 회복되었다. 결론적으로 PVDF 시트를 암모니아 감지용 센서 기판으로 사용하는 경우에 가장 민감한 색상 변화와 좋은 색상 가역성을 보여 주었다. 따라서, 이후 연구에서는 PVDF를 센서 기판으로 사용하여 색변환 센서를 제작하였다.
TVBN에 의한 색상 변화는 산-염기 반응에 의한 pH 지시 염료의 분자 구조 변화에 의해 발생한다. 이전 연구를 통하여 암모니아 감지에 높은 감도와 안정성을 보인 염료가 BCG임을 확인하였다[18]. 따라서 본 연구에서도 BCG염료를 사용한 센서를 제작하였고, 감지에 영향을 주는 산성 및 보조 첨가물에 따른 감지 특성을 확인하여 첨가물의 종류와 양을 최적화 하였다. Fig. 2a는 산성 첨가물인 OA와 TA를 염료 용액에 15mM 첨가하여 제작한 센서에 대한 0 – 5 ppm 암모니아 농도 구간에서의 색변환 세기의 변화를 보여준다. 산성 첨가물을 넣어준 경우에 넣지 않은 감지막과 비교하여 감지 감도가 증가하였고, 또한 OA 에 비하여 TA 의 감도 증대 효과가 컸다. 결과적으로 BCG 용액에 15 mM TA를 첨가해준 조건이 가장 감도가 우수하였고, 이를 최적화된 조건으로 사용하였다. 산성 첨가물에 의해서 감도가 증가하는 이유로는 산성 화합물이 첨가된 경우에 산성 BCG 와 염기성 암모니아 사이의 산-염기 반응을 방해하는 경쟁 물질로 작용하여 청색 변환을 지연하지만, 반면에 대기에 존재하는 다량의 양쪽성 물에 의해서 센서의 초기 색상이 변화는 것을 방지 할 수 있어서 색상 변화 세기와 안정적인 초기 색상 유지 측면에서 장점을 가진다.
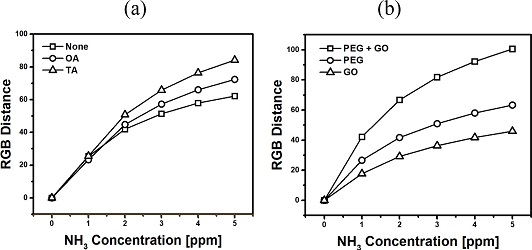
Effects of different dye solutions on sensing magnitude: (a) addition of acid additives (OA and TA) and (b) addition of other additives (PEG and GO). Detection time = 10 min.
보조 첨가제로는 친수성 특성을 가지는 PEG와 GO를 테스트하였다. 감지 민감도를 이용하여 먼저 개별 첨가물의 최적의 양을 확인하였다. PEG는 7.5 μL를 첨가한 경우에, GO는 20 μg를 추가한 경우에 가장 우수한 특성을 보여주었다. Fig. 3b는 BCG/TA로 제조된 염료 용액에 PEG, GO, 또는 PEG/GO를 첨가한 경우의 암모니아 농도에 따른 색상 변화 세기의 변화를 보여준다. PEG 및 GO 첨가량은 최적량에 해당하는 7.5 μL과 20 μg를 각각 사용하였다. 얻어진 결과로부터 암모니아 감지 감도가 PEG/GO > PEG > GO 순으로 감소함을 확인하였다. PEG 및 GO 첨가에 의한 감도 향상은 두 화합물이 센서 기판을 친수성으로 변화시키고 유기 작용기가 존재하여 암모니아를 센서 기판에 효과적으로 고정시키는 역할을 하는 것으로 추정된다.
위에서 언급한 최적화 연구를 통하여, 암모니아에 가장 큰 감지 민감도와 수분에 대한 영향이 최소화된 염료 용액은 1.5 mL물과 0.5 mL 에탄올로 구성된 혼합 용매에 4.2 mg BCG, 5.7 mg TA, 7.5 μL PEG, 20 μg GO용질을 추가한 경우임을 확인하였다.
3.2. 최적화된 BCG 센서의 암모니아 감지 특성
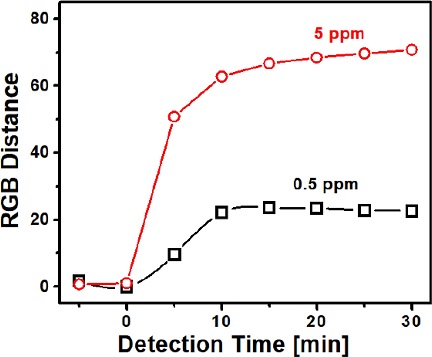
Fig. 3은 암모니아 농도 0.5및 5 ppm 조건에서 감지 시간에 따른 색변환 세기를 보여주는 곡선이다. 측정은 상온, 상대습도 50% 조건에서 수행하였다. 색변환 세기는 10분까지는 급격하게 증가하지만 그 이후에는 변화 폭이 작아지면서 안정화 됨을 보여준다. 특히 두 농도에서 15 분 이후에는 안정한 색상 변화 세기를 보여주었고, 이는 센서의 감지 시간이 15분 정도임을 보여준다. 또한 농도가 높은 경우에 안정화된 색상 변화 세기가 크게 관측되었다. 이것은 15분의 측정 시간에서 얻어진 색변환 감지 세기를 이용하여 농도를 예측할 수 있음을 의미한다. 이러한 암모니아 농도-색변환 세기 사이의 비례 관계는 기체 상에 존재하는 농도에 비례하여 고체 센서에 암모니아가 포획되고, 이로 인하여 염료에서 색상 변환이 일어나는 기작으로 설명 가능하다.
감지 민감도는 센서의 가장 중요한 사양 중에 하나이다. 음식물이 부패하기 시작하여 초기에 발생하는 TVBN 화합물의 농도가 1 ppm이하이므로 본 연구에서는 고감도 감지 민감도가 요구된다.
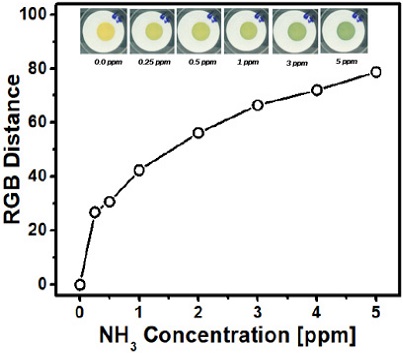
Fig. 4는 최적화된 센서를 이용하여 얻어진 암모니아 농도에 따른 색변환 세기를 보여주는 결과이다. 또한 개별 농도에서 얻어진 센서 사진들도 보여주고 있다. 센서 측정 조건으로는 상온, 상대습도 = 50%, 감지 시간 = 15분을 이용하여 흐름 유량이 1,000 sccm인 조건에서 실험하였다. 얻어진 결과에 따르면 암모니아 0에서 5 ppm 구간에서 색변환 세기가 점진적으로 증가하는 경향을 보여주었다. 낮은 농도에서 더 급격한 증가를 보이다가 높은 농도 영역에서는 점차적으로 증가 폭이 감소되었다. 센서의 색상은 초기 노란색에서 연노란색, 연두색으로 변화됨을 사진에서 확인할 수 있었다. 특히 가장 낮은 농도인 0.25 ppm 암모니아 노출 조건에서 RGB 거리가 20 이상으로 관측되었고, 사진에서도 약한 연두색을 육안으로 확인할 수 있었다. 얻어진 결과는 최적화된 센서의 최저 검출 한계(LOD)가 0.25 ppm 이하임을 암시하고, 이러한 결과는 기존에 PAN 나노섬유 기판 위에 BCG, OA, PEG로 구성된 염료 용액을 이용하여 제작한 센서에 비하여 우수한 감지 민감성을 보여준다[18].
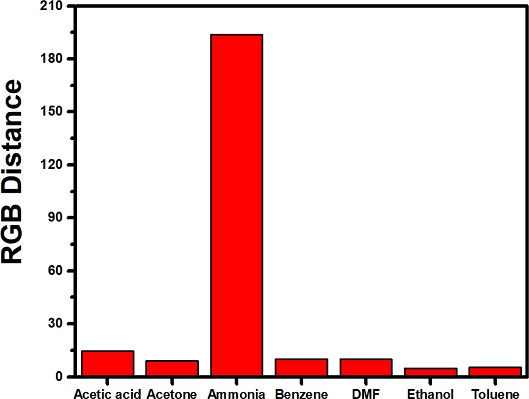
암모니아에 대한 센서의 감지 선택성을 확인하기 위하여 일반 휘발성 용매들에 대한 색상 변화 실험을 수행하였다. Fig. 5는 암모니아수를 포함한 다양한 유기 용제에서 발생하는 휘발성 분자에 의해서 유도되는 색상 변화 세기를 보여주고 있다. 실험은 상온에서 피감지 용액 또는 용매를 플라스크에 일정량 넣은 이후에 용기의 빈 공간에 센서를 위치시킨 이후에 밀폐 조건에서 5분 경과한 이후에 색상 변화를 관측하였다. 테스트한 아세트산(2.0%), 아세톤(23%), 벤젠(11%), DMF(0.46%), 에탄올(7.3%), 톨루엔(3.6%) 6종의 유기 용재에 대하여 8% 미만의 미미한 색상 변화를 확인하였다. 얻어진 사진에서도 암모니아수에서만 뚜렷한 청색 색변화가 관측되었고, 다른 유기 용제의 경우에는 초기 노란색이 잘 유지 되었다. 이러한 결과는 BCG 색 변환 센서의 경우에 염기성을 가지지 않는 휘발성 분자들에 대해서는 색변환 감지 특성이 거의 없음을 잘 보여준다.
온도 변동에 의해서 센서의 감지 특성이 영향을 받을 수 있으므로, 이를 확인하기 위하여 열 충격 전후의 감지 특성을 비교하였다. -40oC 조건에서 2시간, 85oC 조건에서 2시간 보관하는 것을 3회 반복하는 열 충격을 센서에 인가하였고, 센서 측정 조건은 상온, 상대습도 = 50%, 5 ppm 암모니아 15분 노출 조건을 사용하였다. 열 충격 후의 색변환 세기를 열 충격 전과 비교하였을 때, 90% 이상의 감지 세기를 보여주었다. 또한 색상 변화의 회복 가역성에도 크게 변화가 없음을 확인하였다. 이러한 결과는 극단적인 환경에 센서를 장시간 노출되더라도 색변화 세기 및 회복 특성이 잘 유지 됨을 보여준다.
3.3. 연어 시료의 부패도 모니터링 실험
연어 시료가 부패하면 TVC가 증가하고, 미생물에 의한 단백질 분해로 인하여 TVBN 배출 농도도 증대 된다. 이러한 가설에 기반하여 연어 보관 시간에 따른 색변환 센서의 감지 세기와 생균수 측정법을 이용한 TVC 수치를 동일한 시료에서 측정하는 실험을 수행하였다.
Fig. 6a는 상온에서 연어를 보관한 시간에 따른 미생물 TVC 수치의 변화를 보여준다. TVC 수치는 실험 시작 후 24시간 동안 지수함수적으로 증가하였으며, 그 이후에는 증가 폭이 둔화되면서 안정화된 수치를 보여주었다. 실제 초기 미생물 TVC는 3.2 × 105 cfu/g 에서 24시간 후에 1.4 × 109 cfu/g로 급격하게 증가하고, 28 시간 이후에는 3.1 × 109 cfu/g 내외의 일정한 수치를 보여주었다. 이러한 미생물 성장 곡선은 일반적으로 관측되는 것으로, 24시간까지는 배지가 미생물 성장에 필요한 조건을 제공하지만 그 이후에는 배지의 영양분이 부족하여 미생물 성장이 제한되면서 미생물 TVC가 일정한 값에 수렴하는 것이다.
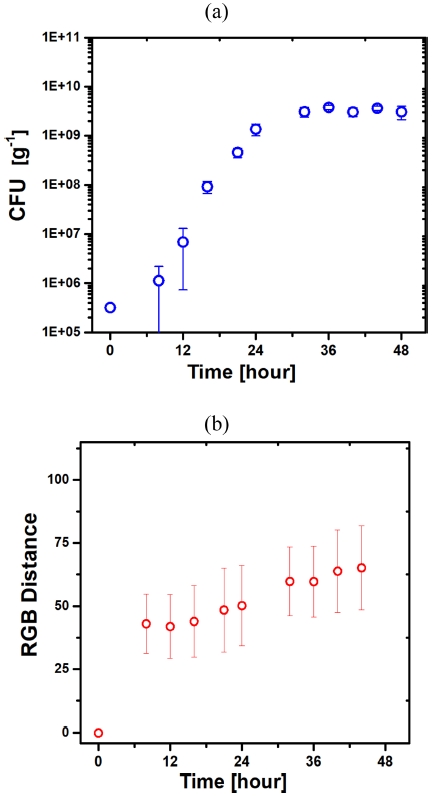
Variations of (a) microorganism population and (b) colorimetric sensor response as a function of a storage time of salmon filet at room temperature.
Fig. 6b는 상온에서 연어 보관 용기 내부의 설치된 색변환 센서에서 관측한 색변화 세기를 보관 시간에 따라서 도식화한 곡선이다. 색변화 세기(RGB 거리)는 초기 8 시간 동안 0에서 43까지 급격하게 증가하였고, 그 이후에는 완만하게 증가하여 48시간 후에는 65가 되었다. 이러한 증가 곡선은 Fig. 6a의 TVC 결과와 차이가 있음을 보여준다. 즉, 미생물 개체수 증가에 비하여 색상 변화가 처음 8 시간 이내에 급격하게 일어남을 의미한다. 만약, 색상 변화 세기가 TVBN 농도에 의해서 결정되었다면, 초기에 빠른 색변화는 음식물 부패 초기 단계를 잘 대변하기 때문에 이를 이용하여 음식물 품질의 초기 감식이라는 측면에서 유리한 점을 갖는다. 초기에 급격한 색상 변화를 보여주는 다른 요인으로 음식물이 밀폐된 용기에 존재함으로써 습도가 매우 높은 상태로 변화함으로써 높은 습도에 의해 색변화 세기가 증대되는 것을 생각할 수 있다. 현재의 실험으로는 명확하게 구분하지 못하였지만 2가지 요인이 동시에 작용한 것으로 사료된다. 결론적으로 예비적인 실험 결과지만 연어 보관 시간에 따른 미생물 TVC 및 색변환 세기 실험을 통하여, 음식물 품질 저하(부패)에 의한 미생물 증대 및 TVBN 농도 증가를 확인할 수 있었다. 이러한 결과는 TVBN 색변환 센서를 이용하여 간단히 육안을 통하여 음식물의 품질을 평가하는 수단으로 사용 가능함을 보여준다.
4. 결 론
BCG 염료를 사용한 색변환 센서를 제작하는 최적의 조건과 암모니아 감지 특성을 확인하였다. 염기성 TVBN 센서 제조하는 최적의 조건으로는 1) 3 mM BCG, 15 mM TA, 7.5 μL PEG, 20 μg GO로 구성된 염료 용액을 사용 2) PVDF 시트 위에 드롭-캐스팅 방법으로 감지막을 제작 3) 대기 수분의 영향을 최소화 하기 위하여 감지막을 PET 필름과 PTFE 시트로 보호된 밀봉 구조를 사용하는 것이었다. 최적의 BCG 센서는 암모니아 평가를 통하여 15분의 감지 시간, 0.25 ppm 이하의 검출 한계, 비 염기성 분자에 대한 우수한 선택성, 열 충격(-40oC, 85oC)에 대한 내구성을 확인하였다. 최종적으로 실제 연어 고기를 이용하여 시료의 상온 보관 시간에 따른 색변화 세기와 미생물 TVC 측정을 통하여, 개발된 TVBN 색변환 센서가 실시간 음식물 품질 모니터링 센서로 응용 가능함을 보여주었다.
Acknowledgments
이 논문은 2018년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(No. 2018R1D1A1B07041567)과 ㈜삼성전자에서 지원 받았습니다.
References
- D. Y. C. Fung, “Microbial hazards in foods: food-borne infections and intoxications”, in Handbook of meat processing, F. Toldra, Ed. John Wiley & Sons, pp. 481-500, 2010.
-
H. J. Hoben and P. Somasegarn, “Comparison of the pour, spread, and drop plate methods for enumeration of rhizobium spp. in inoculants made from presterilized peat”, Appl. Environ. Microbiol., Vol. 44, No. 5, pp. 1246-1247, 1982.
[https://doi.org/10.1128/AEM.44.5.1246-1247.1982]

-
K. Kogure, U. Simidu, and N. Taga, “A tentative direct microscopic method for counting living marine bacteria”, Can. J. Microbiol., Vol. 25, pp. 415-420, 1979.
[https://doi.org/10.1139/m79-063]

-
P. Castro, J. C. P. Padron, M. J. C. Cansino, E. S. Velazquez, and R. M. D. Larriva “Total volatile base nitrogen and its use to assess freshness in European sea bass stored in ice”, Food Control, Vol. 17, No. 4, pp. 245-248, 2006.
[https://doi.org/10.1016/j.foodcont.2004.10.015]

-
M. Chai and J. Pawliszyn, “Analysis of environmental air samples by solid-phase microextraction and gas chromatography/ion trap mass spectrometry”, Environ. SCI. Technol., Vol. 29, No. 3, pp. 693-701, 1995.
[https://doi.org/10.1021/es00003a017]

-
H. Nanto, T. Minami, and S. Takata, “Zinc-oxide thin-film ammonia gas sensors with high sensitivity and excellent selectivity”, J. Appl. Phys., Vol. 60, No. 2, pp. 482-484, 1986.
[https://doi.org/10.1063/1.337435]

- S. Jung, Y. B. Cho, and Y. S. Kim “Highly sensitive colorimetric formaldehyde gas sensors using nylon sheet and dye”, J. Sens. Sci. Technol., Vol. 26, No. 6, pp. 420-426, 2017.
-
R. W. Sabnis, Handbook of acid-base indicators, CRC Press, Boca Raton, pp. 43-361, 2008.
[https://doi.org/10.1201/9780849382192]

-
A. Mills, L. Wild, and Q. Chang, “Plastic Colorimetric film sensors for gaseous ammonia”, Mikrochim. Acta, Vol. 121, No. 4, pp. 225-236, 1995.
[https://doi.org/10.1007/BF01248252]

-
Y.-C. Chang, H. Bai, S.-N. Li, and C.-N. Kuo, “Bromocresol green/mesoporous silica adsorbent for ammonia gas sensing via an optical sensing instrument”, Sensors, Vol. 11, No. 4, pp. 4060-4072, 2011.
[https://doi.org/10.3390/s110404060]

-
M. K. Morsy, K. Zor, N. Kostesha, T. S. Alstrom, A. Heiskanen, H. El-Tanahi, A. Sharoba, D. Papkovsky, J. Larsen, H. Khalaf, M. H. Jakobsen, and J. Emneus, “Development and validation of a colorimetric sensor array for fish spoilage monitoring”, Food Control, Vol. 60, No. 1, pp. 346–352, 2016.
[https://doi.org/10.1016/j.foodcont.2015.07.038]

-
S. L. M. Neto, A. V. Wangenheim, E. B. Pereira, and E. Comunello, “The use of euclidean geometric distance on RGB color space for the classification of sky and cloud patterns”, J. Atmos. Ocean. Technol., Vol. 27, No. 9, pp. 1504-1517, 2010.
[https://doi.org/10.1175/2010JTECHA1353.1]

-
M. Lindner, A. Kolb, and K. Hartmann, “Data-fusion of PMD-based distance-information and high-resolution RGB-images”, IEEE, Int. symp. on signals circuits syst., pp. 1-4, 2007.
[https://doi.org/10.1109/ISSCS.2007.4292666]

-
A. Pacquit, J. Frisby, D. Diamond, K. T. Lau, A. Farrell, B. Quilty, and D. Diamond, “Development of a smart packaging for the monitoring of fish spoilage”, Food Chemistry, Vol. 102, No. 2, pp. 466–470, 2007.
[https://doi.org/10.1016/j.foodchem.2006.05.052]

-
A. Pacquit, K. T. Lay, H. McLaughlin, J. Frisby, B. Quilty, and D. Diamond, “Development of a volatile amine sensor for the monitoring of fish spoilage”, Talanta, Vol. 69, No. 2, pp. 515-520, 2006.
[https://doi.org/10.1016/j.talanta.2005.10.046]

-
A. Listyarini, W. Sholihah, and C. Imawan, “A paper-based colorimetric indicator label using natural dye for monitoring shrimp spoilage”, IOP Conf. Ser.: Mater. Sci. Eng., Vol. 367, No. 1, pp. 012045, 2018.
[https://doi.org/10.1088/1757-899X/367/1/012045]

-
J. D. Buck and R. C. Cleverdon, “The spread plate as a method for the enumeration of marine bacteria”, Limnol. Oceanogr., Vol. 5, No. 1, pp. 78-80, 1960.
[https://doi.org/10.4319/lo.1960.5.1.0078]

-
A. T. Hoang, Y. B. Cho, J.-S. Park, Y. Yang, and Y. S. Kim, “Sensitive naked-eye detection of gaseous ammonia based on dye-impregnated nanoporous polyacrylonitrile mats”, Sens. Actuator B, Vol. 230, No. 1, pp. 250-259, 2016.
[https://doi.org/10.1016/j.snb.2016.02.058]