약물처리된 심장세포의 세포 수축력 측정을 위한 병렬 폴리머 캔틸레버 제작
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Thus far, several in vivo biosensing platforms have been proposed to measure the mechanical contractility of cultured cardiomyocytes. However, the low sensitivity and screening rate of the developed sensors severely limit their practical applications. In addition, intensive research and development in cardiovascular disease demand a high-throughput drug-screening platform based on biomimetic engineering. To overcome the drawbacks of the current state-of-the-art methods, we propose a high-throughput drug-screening platform based on 16 functional high-sensitivity well plates. The proposed system simulates the physiological accuracy of the heart function in an in vitro environment. We fabricated 64 cantilevers using highly flexible and optically transparent silicone rubber and placed in 16 independent wells. Nanogrooves were imprinted on the surface of the cantilever to promote cell alignment and maturation. The adverse effects of the cardiovascular drugs on the cultured cardiomyocytes were systematically investigated. The 64 cantilevers demonstrated a highly reliable and reproducible mechanical contractility of the drug-treated cardiomyocytes. Real-time high-throughput screening and simultaneous evaluation of the cardiomyocyte mechanical contractility under multiple drugs verified that the proposed system could be used as an efficient drug-toxicity test platform.
Keywords:
High-throughput screening, Polymeric cantilever, Cardiomyocytes, Drug screening1. 서 론
최근 신약 개발 및 생체 모방 공학의 연구는 BT(bio technology), NT(nano technology)가 융합된 시스템 생물학 혹은 시스템 생명공학 연구를 요구한다[1]. 이러한 in vitro system 은 high-throughput screening을 통하여 소량의 실험 재료를 이용하여 다량의 실험을 일괄적으로 수행할 수 있는 lab on a chip 또는 organ on a chip의 다양한 모델들을 통하여 구현되고 있다[2, 3]. 이처럼 생체의 기능을 모방한 in vitro 플랫폼은 신약 개발 또는 심장 독성 연구에 있어서 보다 적은 비용으로 높은 정확성을 갖는 전임상 분석 결과 확인이 가능하다.
심장에 독성을 나타내는 약물은 수축 기능에 장애를 발생시킨다. 대표적인 심장의 수축 기능 문제로 인한 질병으로는 심부전이 있으며, 주로 심장 질환 및 고혈압과 같은 심혈관 질환에 의해 유발되지만 몇몇 종류의 약물은 심혈관 질환이 없는 환자에서 심부전을 유발하거나 좌심실이 손상된 환자에게서 심부전의 발생을 촉진시킬 수 있다[4].
심근 세포의 기계적 수축력을 정량적으로 측정하는 방법으로 micro post array 와 flexible cantilever를 기반으로 측정할 수 있다. 이 방법은 심근 세포의 수축/이완에 의하여 발생하는 구조체의 변위를 측정하고 정량적인 분석이 가능하다. Micro post array는 심근 세포의 수축력에 의한 원 기둥의 변위를 광학 현미경과 이미지 프로세싱 기법을 통하여 분석한다[5]. 하지만 이러한 분석 방법은 낮은 스크리닝율을 갖고, 단일 심근세포에 의한 분석 방법은 생리학적 정확성이 낮다. Flexible cantilever는 일반적으로 이미지 프로세싱 방법을 통하여 캔틸레버의 변형을 분석한다[6]. 하지만 이미지 프로세싱 방법은 데이터의 양이 많고, 후처리가 필요하다. 분석 방법의 복잡성을 해결하고자 제안된 레이저 변위계를 이용한 분석 방법은 측정이 간단하고 높은 정확도를 갖지만 실시간 측정을 위해서는 다수의 레이저 변위계가 필요하여 하드웨어 구성에 한계를 나타낸다[7]. 광학계를 이용한 분석 방법의 한계를 극복하고 실시간 high-throughput 스크리닝을 위하여 제안된 집적화된 센서를 이용한 비 광학적 측정 방식은 유연한 스트레인 센서를 이용하여 다중 채널에 대한 실시간 분석을 가능하게 하였다[8].
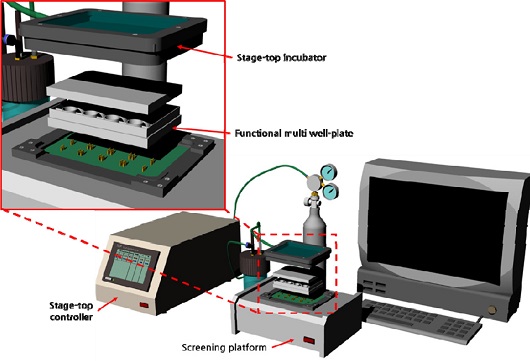
본 연구는 심근 세포의 기계적 수축력 변화를 높은 처리량으로 실시간 측정 가능한 플랫폼의 개발을 목표로 한다. 제안된 플랫폼은 기능성 16 well-plate, drug toxicity screening platform 그리고 PC 기반의 분석 프로그램으로 구성된다(Fig 1). 16 well-plate의 각각의 well 에는 4개의 폴리머 캔틸레버가 위치하고 4개의 캔틸레버에 대한 출력값은 평균화 되어 약물에 대한 독성 여부 판단에 신뢰성을 향상시켰다. 전기적 신호로 변환된 심근세포의 수축력은 drug toxicity screening platform을 통하여 PC 기반의 분석 프로그램으로 실시간 그래프로 표현되며 beating rate, beating duration 그리고 수축력 분석이 가능하다. 또한 세포 부착 및 정렬을 위하여 캔틸레버 길이 방향으로 imprinting된 groove는 단시간에 세포를 성숙시키는 것이 가능하다. 제안된 기능성 16 well-plate platform 은 심근 세포의 조직 수준에서 수축력 분석을 통하여 약물 독성 검사의 high-throughput screening platform으로 활용을 기대한다.
2. 설계 및 제작
2.1 센서가 집적화된 4-캔틸레버 어레이의 설계 및 제작
심근세포의 수축력 측정을 위한 4-캔틸레버 어레이는 Fig. 2. (a) 와 같이 polymer part 와 glass part 로 구성된다. Polymer part는 금속 스트레인 센서와 상부 표면에 imprinting된 groove가 있다. 배양된 심근세포의 수축력에 따라서 소자의 기계적 변형이 전기적 저항 변화로 발생한다. Glass part는 신호 측정을 위한 전극패드 와 2개의 고정 저항이 형성되었으며, plasma bonding을 통하여 polymer part 와 전기적으로 연결되어 하프-브릿지 회로가 구성된다. 이를 통하여 Fig. 2. (b) 와 같이 세포의 수축, 이완에 따른 캔틸레버의 스트레인 변화를 출력 전압으로 측정 가능하다. 또한 세포의 정렬 및 심근세포 골격을 조직화할 수 있도록 imprinting 된 groove 가 형성되어 수축력 및 성숙도의 증가가 가능하다. Fig. 2 (c)는 캔틸레버 자유단에 하중이 인가되었을 때 발생하는 변위와 스트레인 분포의 유한요소해석 결과를 보여준다. 해석 결과를 바탕으로 금속 스트레인 센서는 캔틸레버의 고정단에서 3 mm 앞부분에 형성되었다.
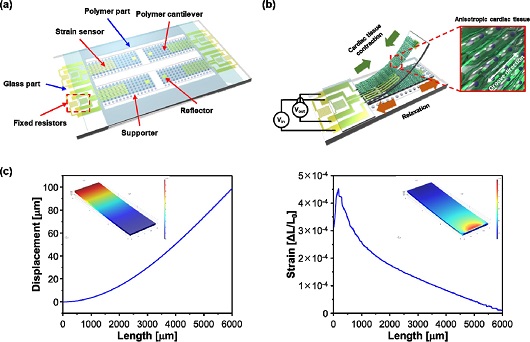
Design of functional well-plate. (a) Schematic of a 4-cantilever array, (b) Sketch of the device principle, (c) FEM simulation results of polymer cantilever according to contraction force and strain distribution of cardiomyocytes
Micromachining process를 이용하여 제작되는 4-캔틸레버 어레이의 공정 과정을 Fig. 3에 나타내었다. 본 연구에서 사용된 폴리머 캔틸레버는 Si rubber를 사용하였으며, 기존의 PDMS 와 비교하여 상대적으로 높은 Young’s modulus 와 낮은 열 팽창 계수로 인하여 금속이 안정적으로 증착 되고 층간 박리 현상이 발생하지 않는다. Si rubber film 에 nano/micro groove 패턴을 위하여 groove mold 상부에 Si rubber (KEG-2000-80A / B, Shin-Etus) 복합체를 2 g 올려 놓는다. 다음으로는 Si rubber의 두께 조절을 위하여 가장자리에 120 μm 두께의 feeler gauge (NIKO, Feeler 0.12)을 위치시키고, PI(Polyimide) film을 덮고 열-압착기를 사용하여 30 분 동안 130oC에서 4 MPa의 압력을 가하여 경화하였다 (Fig. 3 (a-1)). 다음으로 groove 가 패턴된 Si rubber 필름의 하부에 shadow mask 를 올려 놓고 E-beam evaporator를 이용하여 Ti/Au (5 nm / 100 nm) 을 증착 하였다(Fig. 3 (a-2)). 배양액 환경에서 장시간 사용될 센서의 안정성 향상을 위하여 PDMS encapsulation layer (~ 10 μm)를 산소 기반의 대기압 플라즈마 처리(CUTE-1MPR, Femto Science Inc.) 후에 화학적으로 접합하였다 (Fig. 3 (a-3)). Roll to plate 장비 (TSUKATANI, BFX) 와 pinnacle를 사용하여 4-캔틸레버 어레이의 형상을 정의하였다 (Fig. 3 (a-4)).
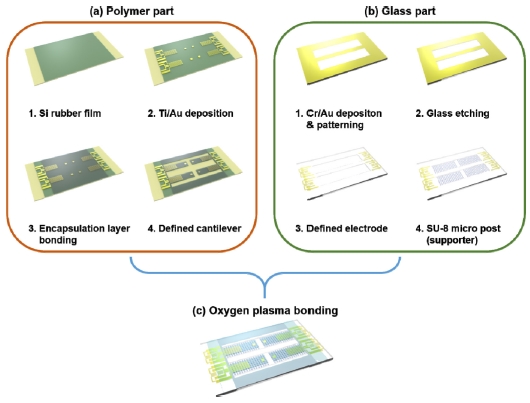
Process flow for the fabrication of the proposed 4-cantilever array integrated with a half bridge sensor
다음은 신호 측정을 위한 전극패드 및 고정 저항이 형성된 glass part의 제작 공정이다. Glass part는 폴리머 캔틸레버의 기판으로 사용되며, 폴리머 캔틸레버 몸체에 형성된 전극에 외력이 인가되는 것을 방지한다. 다음은 glass body의 상세한 제작 공정이다. Glass 기판에 micro well 구성을 위하여 금속 masking layer (Cr/Au)를 패터닝한다 (Fig. 3 (b-1)). 유리 식각을 위하여 HF(Hydrogen fluoride) 사용하여 10 mm (etching rate: 5 mm/min) 깊이로 유리를 식각하였다(Fig. 3 (b-2)). 전극패드 와 고정 저항을 형성하기 위하여 패터닝 후 금속을 식각 하였다(Fig. 3 (b-3)). 캔틸레버의 자중에 의한 처짐을 방지하고 안정적인 세포 배양을 위하여 micro well 영역에 SU-8을 이용한 supporter 구조체를 패터닝 후 dicing saw (AM Technology, NDS200)를 사용하여 19.72 mm × 12.20 mm 크기로 dicing 하였다(Fig. 3 (b-4)). 마지막으로 polymer part와 glass part를 산소 기반의 대기압 플라즈마 처리 (CUTE-1MPR, Femto Science Inc.) 하여 화학적으로 접착하였다(Fig. 3 (c)).
2.2 심근세포 추출 및 배양
모든 동물 실험은 전남대학교 동물윤리위원회로부터 승인 후 진행되었다. NRVM(Neonatal Rat Ventricular Myocytes) isolation은 생후 3일 이내의 Sprague-Dawley Rat에서 적출된 심장을 심방과 심실로 분리하였다. 다음으로 ADS buffer solution (NaCl 120 mM, HEPES 20 mM, NaH2PO4 8 mM, D-glucose 6 mM, KCl 5 mM, MgSO4 0.8 mM, DI water 1L, pH 7.35)을 이용하여 분리된 심실을 washing 한 후 Enzyme Solution (Collagenase 0.5 mg/ml, Pancreatin 0.6 mg/ml, ADS buffer solution 50 ml) 및 preplating을 통해 단일 cardiomyocytes를 획득하였다. 제작된 폴리머 캔틸레버 표면에 fibronectin (Corning)을 효과적으로 코팅하기 위하여 산소 기반의 대기압 플라즈마 처리 (CUTE-1MPR, Femto Science Inc., 80 W, 30 sec)를 통하여 표면 개질 후 fibronectin을 dip-coating 하였다. 획득한 심근세포는 1,000 cell/mm2 밀도로 폴리머 캔틸레버 전면에 분주하였으며, 변위 측정은 배양 후 10일 동안 진행하였다. 또한 심근세포의 배양기간 동안 세포 배양액은 72시간 간격으로 교체하였다.
3. 결 과
3.1 집적화된 스트레인 센서의 특성평가
Fig 4 (a, b)는 제작된 4-캔틸레버 어레이와 기능성 multi well-plate의 광학 이미지를 나타낸다. 캔틸레버 상부 표면에는 imprinting된 nano/micro groove 가 위치하고, 고정단에는 금속 스트레인 센서가 집적화 되었다. 인가된 변위에 대한 스트레인 센서의 특성 평가를 위하여 Lab-VIEW 기반 데이터 수집 시스템 (PXI-4071, National Instruments Inc., Austin, TX, USA)을 사용하여 인가된 변위에 대한 스트레인 센서의 저항 변화를 실시간으로 측정하였다. 5 1/2 디지트로 2 선 저항을 측정 값의 표준 편차는 0.01 Ω 이다[9].
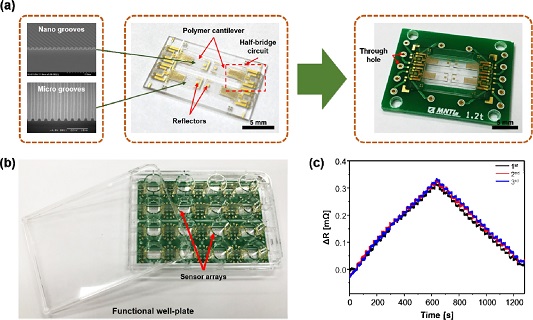
Optical image of (a) Fabricated 4-cantilever array, (b) Functional multi well-plate combined with 4-cantilever array, (c) Resistance change as a function of cantilever displacement
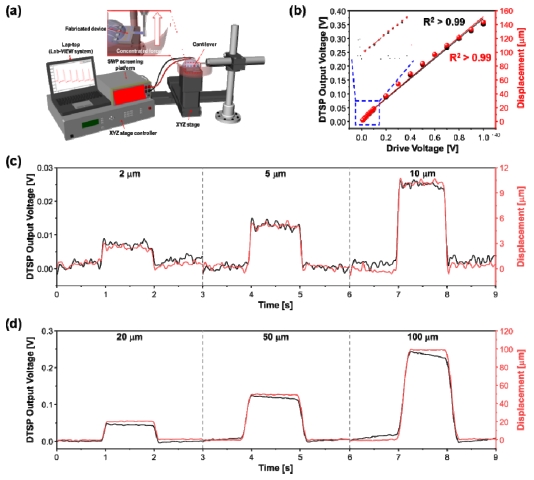
제작된 폴리머 캔틸레버 어레이에 심근세포의 수축/이완과 유사한 거동을 재현하기 위하여 motorized stage를 사용하였다. Stage 상부에 고정된 홀더를 이용하여 캔틸레버 자유단에 집중 하중을 인가하여 캔틸레버에 굽힘을 발생시키고 집적화된 스트레인 센서에 저항 변화를 일으켰다. Ti/Au 스트레인 센서에 총 100 μm의 변위 (strain range: 0 ~ 2.89 × 10-4)를 인가한 후 발생한 저항 변화는 300 mΩ 이다. Fig. 4 (c)는 초기상태에서 100 μm까지 5 μm 간격으로 일정하게 변위를 인가하였을 때 저항 변화를 나타낸다. 제작된 폴리머 캔틸레버는 인가된 변위에 따라서 선형적인 저항 변화량(R2 > 0.99)을 나타낸다.
3.2 집적화된 스트레인 센서의 특성평가
Drug toxicity screening platform의 특성 평가를 위하여 테스트 모듈과 측정 시스템을 구성하였다(Fig. 5 (a)). 테스트 모듈은 캔틸레버를 압전 구동기 위에 올려놓고 외부 하우징을 통하여 고정한 다음 함수 발생기와 piezo-amp를 이용하여 0 ~ 40 V까지 증폭하여 구동하였다. 측정된 1차 공진 주파수는 1.558 kHz 로 선형적으로 증가된 구동 전압에서 집적화된 하프-브릿지 회로의 출력 전압과 캔틸레버 자유단의 변위는 선형적(R2 > 0.99)으로 증가 하였다(Fig. 5 (b)). Motorized stage를 사용하여 구성된 미소 변위 발생기는 외부에서 일정한 힘으로 캔틸레버에 힘을 인가할 수 있으며, 인가되는 힘의 크기 변화에 따라 비례하여 발생하는 저항 변화는 휘스톤 브릿지 회로를 통하여 drug toxicity screening platform에 내장된 noise filter와 Op-Amp를 이용하여 증폭된 전압의 변화로 나타난다. 인가된 힘은 최대 약 760 nN 으로 244 mV 출력값을 얻을 수 있으며, 출력 전압 변화는 3 mV/mm 이다 (Fig. 5(c, d)).
3.3 표면 형상에 따른 심근세포의 수축력 평가 및 약물-용량 반응성
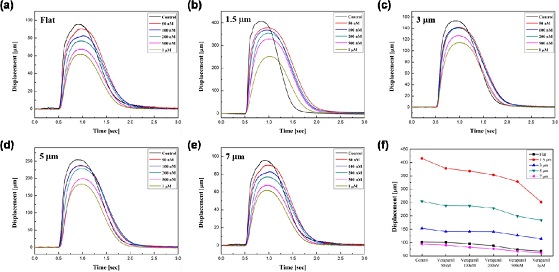
심근세포는 배양 기질의 형태학적 변화에 의하여 이방성의 특징을 보인다. 심근 세포의 높은 구조적 발달을 위하여 imprinting된 groove는 1.5 μm, 3 μm, 5 μm, 7 μm의 line and space를 갖는다. 패턴된 기질에서 심근세포의 이방성 특징을 확인할 수 있으며, groove 크기에 따라 서로 다른 수축력을 확인할 수 있다. 이와 같은 결과는 배양 기질의 형태학적 변화가 세포 골격의 조직화 및 성숙도 뿐만 아니라 부착율을 향상 시켰다는 사실을 증명한다. 또한 향상된 세포 골격과 정렬된 심근세포에 의한 수축력의 집중은 캔틸레버 변위를 약 5배 증가하는 결과를 나타내었다(Fig. 6 (f)). 이와 같은 결과는 배양 기질의 형태학적 변화를 통한 세포 골격의 조직화 및 성숙도 향상이라는 생물학적 의미와 폴리머 캔틸레버의 변위 향상을 통한 추가적인 감도 증가를 기대할 수 있다.
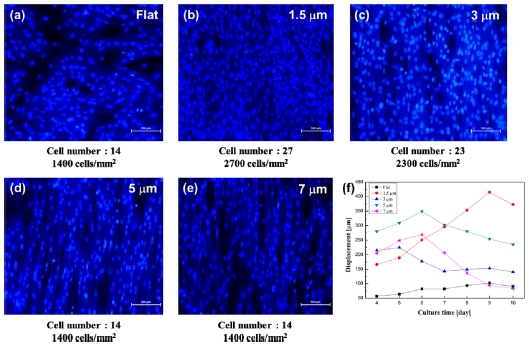
Adhesion rate of cardiomyocytes cultured on various substrates (a) flat, (b) 1.5 mm groove, (c) 3 mm groove, (d) 5 mm groove, (e) 7 mm groove, (f) Changes in contractility according to the culture period of cardiomyocytes cultured on various substrates
위의 결과를 바탕으로 In vitro 환경에서 수축력과 심박수에 영향을 주는 약물에 대한 용량-반응성 연구를 수행하였다. Ca2+ 채널 억제제인 Verapamil 처리에 따른 심근세포의 수축력 감소 반응과 500 nM의 농도에서 EC50을 확인하였다(Fig 7). 기능성 well-plate의 스크리닝 능력은 기존의 광학 시스템이 갖는 복잡성을 해결하고 간단한 측정 방식을 통하여 정확한 데이터 수집 능력을 확인하였다.
4. 결 론
본 연구에서는 기계적 수축력 및 약물 용량-반응성 연구의 낮은 처리량을 개선하기 위하여 기능성 16 well-plate platform을 설계 및 제작하였다. 금속 스트레인 센서 및 하프-브릿지 회로가 구성된 4-캔틸레버 어레이는 유연성과 생체 적합성을 갖는 Si rubber을 이용하여 제작되었으며, polymer part와 glass part로 제작한 후 화학적으로 결합하였다. Drug toxicity screening platform 은 test module 과 미소 변위 발생기를 이용한 특성평가 결과 3 mV/mm의 감도를 나타낸다. 심근세포의 성숙도와 수축력은 최적화된 배양 기질의 형태학적 변화를 통하여 최대 변위를 달성하였다. 본 연구는 기능성 16 well-plate platform의 설계 및 제작 그리고 특성 평가를 통하여 심근세포의 기계적 수축 거동 분석을 통한 다중 고속 약물 스크리닝 및 배양 기질의 표면 형상 변화에 따른 심근세포의 형태학적 특성 분석 플랫폼의 활용 가능성을 증명하였다.
Acknowledgments
본 연구는 과학기술정보통신부와 교육부 재원으로 한국연구재단의 지원을 받아 수행된 연구임 (No.2017R1E1A1A01074550, 2019R1A6A3A13095692)
References
-
J. G. Jacot, H. Kita-Matsuo, K. A. Wei, H. V. Chen, J. H. Omens, M. Mercola, and A. D. McCulloch, “Cardiac myocyte force development during differentiation and maturation”, Ann. N. Y. Acad. Sci., Vol. 1188, pp. 121-127, 2010.
[https://doi.org/10.1111/j.1749-6632.2009.05091.x]

-
K. S. Bielawski, A. Leonard, S. Bhandari, C. E. Murry, and N. J. Sniadecki, “Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing”, Tissue Eng., Part C, Vol. 22, No. 10, pp. 932-940, 2016.
[https://doi.org/10.1089/ten.tec.2016.0257]

-
I. Mannhardt, C. Warncke, H. K. Trieu, J. Müller, and T. Eschenhagen, “Piezo?bending actuators for isometric or auxotonic contraction analysis of engineered heart tissue”, J. Tissue Eng. Regener. Med., Vol. 13, No. 1, pp. 3-11, 2019.
[https://doi.org/10.1002/term.2755]

-
J. L. Tan, J. Tien, D. M. Pirone, D. S. Gray, K. Bhadriraju, and C. S. Chen, “Cells lying on a bed of microneedles: An approach to isolate mechanical force”, Proc. Natl. Acad. Sci., Vol. 100, No. 4, pp. 1484-1489, 2003.
[https://doi.org/10.1073/pnas.0235407100]

-
R. E. Taylor, K. Kim, N. Sun, S.-J. Park, J. Y. Sim, G. Fajardo, D. Bernstein, J. C. Wu and B. L. Pruitt, “Sacrificial layer technique for axial force post assay of immature cardiomyocytes”, Biomed. Microdevices, Vol. 15, No. 1, pp. 171-181, 2013.
[https://doi.org/10.1007/s10544-012-9710-3]

-
J. You, H. Moon, B. Y. Lee, J. Y. Jin, Z. E. Chang, S. Y. Kim, J. Park, Y.-S. Hwang and J. Kim, “Cardiomyocyte sensor responsive to changes in physical and chemical environments”, J. Biomech., Vol. 47, No. 2, pp. 400-409, 2014.
[https://doi.org/10.1016/j.jbiomech.2013.11.013]

-
J. Y. Kim, Y. S. Choi, B. K. Lee, and D. W. Lee, “Surface-patterned SU-8 cantilever arrays for preliminary screening of cardiac toxicity”, Biosens. Bioelectron., Vol. 80, pp. 456-462, 2016.
[https://doi.org/10.1016/j.bios.2016.01.089]

-
D. -S. Kim, Y. J. Jeong, B. K. Lee, A. Shanmugasundaram, and D. -W. Lee, “Piezoresistive sensor-integrated PDMS cantilever: A new class of device for measuring the drug-induced changes in the mechanical activity of cardiomyocytes”, Sens. Actuators, B, Vol. 240, pp. 566-572, 2017.
[https://doi.org/10.1016/j.snb.2016.08.167]

-
T. Kim, T. Lee, G. Lee, Y. W. Choi, S. M. Kim, D. Kang, and M. Choi, “Polyimide encapsulation of spider-inspired crack-based sensors for durability improvement”, Appl. Sci., Vol. 8, No. 3, pp. 367(1)-367(8), 2018.
[https://doi.org/10.3390/app8030367]