세포 배양액의 연속 공급기 제작을 통한 심근세포의 성숙개선에 관한 연구
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, an automated culture media replacement system was developed to analyze changes in the contraction characteristics of cardiomyocytes according to the state of the culture media. For the long-term storage of culture media, a Peltier refrigerator with a temperature of 5 to 8oC was provided and a pH of 7.4 was maintained. The cell culture media of the cardiomyocytes was continuously replaced using interlocking pumps at a flow rate of 0.83 μl/h. The cardiomyocytes in which the culture media was replaced automatically demonstrated lower heartbeats per minute compared to samples in which there was no replacement. However, these cardiomyocytes moved more uniformly and produced greater displacement in one heartbeat cycle. It was observed that the sarcomere length of the cardiomyocytes increased due to the automated culture media replacement system. These cardiomyocytes were found to demonstrate better maturation compared to the control group. The maturation of cardiomyocytes was verified through staining images. The proposed automated culture media replacement system generates a uniform heart rate and improvements in contraction force. Based on the study, patient-specific drug toxicity assessments can be conducted using differentiated cardiomyocytes in induced pluripotent stem cells.
Keywords:
Automatic media replacement system, Cardiomyocytes, Maturation, Contraction force, Heart rate1. 서 론
1960년 후반 처음 시도된 Patch clamp는 심근 세포 내부의 Action Potential Duration (APD) 변화로 약물 독성을 평가한다[1]. 하지만 심장의 활동전위에 관여하는 다양한 채널의 영향을 배제하고 hERG 채널 (K) 단독 영향에 대한 평가만으로 독성을 평가하는 것은 비 임상 시험 결과와 약 30% 불일치하다는 결과가 보고되었다[2]. 이러한 문제를 개선하기 위해 최근 심근세포의 활동전위에 관여하는 다양한 이온 채널 (Na+, Ca2+, K+) 관련 약물을 세포의 전위를 측정하는 MEA (micro electrode array) 분석 및 심근세포의 기계적인 수축력을 분석하는 연구들이 진행되고 있다[3,4]. 검사의 효율 개선을 위해 high-throughput screening system 개발이 요구되며 비성숙 (배아기) 심장세포는 성숙 (성인) 심근에 비해 대사 작용이 다르기 때문에 약물 스크리닝 결과는 성숙/비성숙 세포의 거동이 다르게 나타난다. 심근세포 배양 시 필요한 배양액은 성장에 필요한 양분을 지니고 있으며 배양액 상태에 따라 심장 박동수는 분당 20~100 회로 크게 변화된다. 따라서 새로운 배양액의 지속적인 공급 (pH, 양분)을 통해 심장 약물 독성 평가의 최적화가 필요하다.
심근세포 배양을 위하여 온도 37 ℃ 및 pH 7.4를 유지해야한다. 5 %의 CO2가 보강된 공기를 사용하며 탄산염 완충용액 (carbonate buffer, HCO32-/H2CO3-)이 세포배양액의 pH 7.4를 유지하는데 사용된다[5]. 완충 용액은 수소 이온 농도를 일정하게 유지해야 하는 다양한 분야에서 널리 사용되고 있으며, 생물체내에서도 항상성 (homeostasis)을 유지하는 데 매우 중요한 역할을 한다[6,7].
완충 용액은 실제 생명 유지에도 필수적으로 요구된다. 우리체 내의 pH는 산 또는 염기성 물질을 섭취하는 경우에도 인산용액에 의한 완충효과로 pH 7을 항상 유지하고 있다. pH의 균형이 유지되지 않는다면 체 내의 아미노산 및 효소들이 불활성화 되어 생명을 유지할 수 없으며 더불어 혈액내의 수소이온과 산소의 농도 또한 이러한 완충 작용에 의해 조절이 되고 있다[8]. 외부 환경요인에 의해 세포 배양액의 pH가 급격하게 변하게 되면, 아미노산 등을 비롯한 세포의 성장에 필요한 요소들이 파괴되어 성장 단백질 분석 및 약물독성평가 결과에 큰 영향을 미친다[9]. 세포성장에 있어 필수적인 배양액은 세포의 농도 등에 따라 달라지지만 일반적으로 2~3일 주기로 교환된다. 하지만 배양액의 교환에서 발생하는 pH 및 온도의 급격한 변화는 미성숙한 세포의 성장에 영향을 미칠 수 있음에도 불구하여 관련한 연구가 체계적으로 이루어지고 있지는 않은 실정이다.
본 논문에서는 세포배양액의 상태에 따라 변화하는 심근 세포의 수축 특성 변화 최소화를 위하여 배양액 온도 유지 장치, 세포 배양액 자동 공급 및 교체 펌프를 제안하고, 이를 제작하여 2~3일 주기로 수동으로 배양액을 교체한 심근세포와 수축 특성 및 성숙도를 비교 분석하였다. 본 연구에서 제안한 연속 또는 순환형 배양액 공급시스템은 미성숙 세포의 안전성 측면에서 큰 도움을 줄 수 있을 것으로 기대된다.
2. 연구 방법
2.1 세포 배양액 보관을 위한 펠티어 냉장고
세포 배양액은 심근세포의 성장에 필요한 양분 및 pH 7.4유지를 위한 완충용액으로 이루어지며 장기간 보관을 위해 4oC를 유지해야한다. 4oC에서 보관된 세포 배양액은 교체 시 발생하는 온도 shock 방지를 위해 37oC bath에서 pre-warming을 진행한다. 장시간 상온에 노출된 배양액의 pH는 7.7~7.8로 증가하고 배양액 교체 후 5% CO2 인큐베이터에 보관하면 48시간 이후 pH 7.4로 다시 감소 및 유지된다. 외부환경 온도에 따라 변화하는 배양액의 pH 변화를 최소화 하기위해 펠티어 소자를 이용한 온도 유지장치를 제작하였다. 펠티어 소자는 세라믹기판과 납 그리고 pellet를 이루는 N, P 형 소자이다. 열전소자를 이용한 냉각, 가열 원리는 서로 다른 2개의 N형, P형 열전반도체 소자로 구성된 열전회로에 전류가 흐를 때 한 접합면은 냉각되고 다른 부위는 가열되는 현상이 일어난다 [8]. 2종의 금속 대신 전기전도 방식이 다른 비스무트(Bi), 텔루트(Te) 등 반도체를 사용하면, 효율성이 높은 흡열, 발열 작용을 하는 펠티어 소자를 얻을 수 있다. 이를 이용하여 세포 배양액 온도 및 pH 유지를 위한 펠티어 냉장고를 제작하였다.
2.2 세포 배양액의 시간에 따른 pH 변화
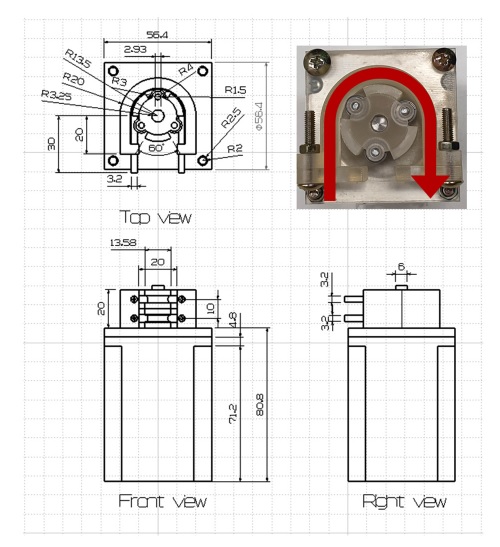
Fig. 1은 제작된 펠티어 냉장고, 스텝 모터 펌프 및 stage-top 인큐베이터로 이루어진 세포 배양액 자동 교체 시스템을 나타낸다. 펠티어 냉장고는 발열부 방열판, 냉기 방열판, 쿨링팬, 단열제 및 아크릴 케이스로 구성되었고 5~8oC의 온도를 유지하며 배양액의 pH는 7.39 ± 0.15의 값을 측정하였다(Table 1). 심근세포는 온도 37oC, CO2 5% 및 상대습도 100%가 유지되는 인큐베이터에서 배양되며 자동 배양액 교체와 수동 배양액 교체 심근세포 대조군으로 배양하였다. 펠티어 냉장고에서 스텝 모터펌프 및 인큐베이터까지 세포 배양액은 pH 7.4를 유지하였다.
2.3 세포 배양액 교체 및 공급을 위한 펌프 제작
지속적인 세포 배양액 교체 및 공급을 위해 롤러의 RPM 조절하여 유량 제어가 가능한 스텝 모터 기반 연동 펌프 제작하였다. 연동 펌프는 미세 유량에 대한 정밀 제어가 가능하고 사용되는 튜브 이외에 세포 배양액과의 접촉이 없어 오염 가능성이 낮은 장점이 있다. 3D 프린터를 이용하여 튜브를 고정하는 하우징을 최소 1포인트 이상 밀착되는 구조로 제작하였다. 펌프의 구동을 위해 스텝 모터를 사용하였고 아두이노 프로그램으로 제어하였다. 스텝 모터는 펄스(pulse)가 입력될 때마다 일정한 각도로 모터가 회전하도록 제어된다. 이 때 회전각은 스텝각이라 부른다. 스텝 모터를 사용하는데 가장 이점이 되는 부분은 스텝 각을 작게 하였을 때 모터의 속도를 조절함으로써 정밀도를 향상시킬 수 있다. 스텝 모터 드라이버는 스텝 모터를 제어하는 역할을 하면 스텝 모터의 최소 스텝 각을 잘게 나누어 마이크로 스텝 각으로 회전하게 만드는 역할을 한다. 스텝 모터의 한스텝에 0.05625도의 회전을 제어 가능하고 펄스 간 간격을 조정하여 회전속도에 따른 미세 유량을 측정하였다.
2.4 세포배양 및 생물학적 성숙도 평가
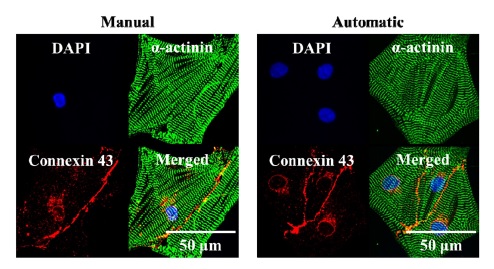
배양액이 지속적으로 교체 및 공급되는 심근세포와 2일 주기로 교체되는 대조군 심근세포의 생물학적 성숙도 평가를 위해 세포배양 2일후부터 배양액 교체를 진행하였으며 배양 10일후 형광 염색을 진행하였다. 배양된 심근세포는 paraformaldehyde (3.7%, Sigma-Aldrich)와 Triton X (0.1%, Sigma-Aldrich)를 이용하여 실온에서 10분간 permeabilize 한다. Phosphate-buffered saline (PBS, Takara)를 이용하여 3회 permeabilization 용액을 washout하였다. 1% Bovine Serum Albumin (BSA, Sigma-Aldrich)로 실온에서 nonspecific binding을 30분간 진행하였다. 이후 Primary anti-body (monoclonal anti actin (α-sarcomere and connexin 43))를 1%의 BSA와 1:200 비율로 혼합 후 120분 동안 실온에서 반응하였다. 다시 secondary antibody (Alexa-Flour 488, 568 goat anti-mouse IgG conjugate)를 1% BSA와 1:200 비율로 혼합하여 90분 동안 실온에서 반응하였다. 마지막으로 핵염색을 위한 DAPI solution (4′, 6-Diamidino-2-phenylindole)을 추가하여 15분동안 37oC에서 반응하였다(Fig. 3).
3. 결과 및 고찰
3.1 스텝 모터 펌프의 RPM에 따른 유량
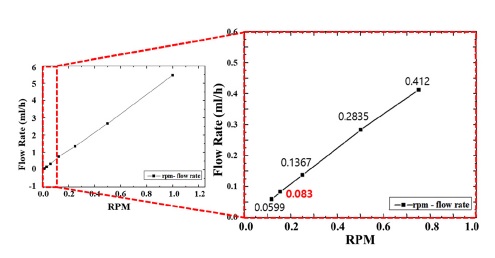
제작한 스텝 모터 펌프의 RPM을 변화하면서 유량 변화를 측정하였다. 기존 세포 배양액의 수동 교체는 2일주기로 4 ml의 양이 교체되기 때문에 목표한 유량은 0.0833 ml/hour로 설정하였다. RPM은 1에서 시작하여 0.5, 0.25, 0.125 순으로 줄이면서 미세 유량 변화를 측정하였다. Fig. 4는 스텝 모터 펌프의 RPM에 따른 유량 변화를 나타낸다. RPM이 감소할수록 유량은 선형으로 감소하며 0.152 RPM에서 0.0849 ml/hour의 근사값을 측정하였다. 스텝 모터를 통해 세포 배양액을 지속적으로 공급 및 교체하였고 수동 배양액 교체 심근세포와 심장 박동수 변화를 비교하였다.
3.2 배양액 상태에 따른 심근세포의 성숙
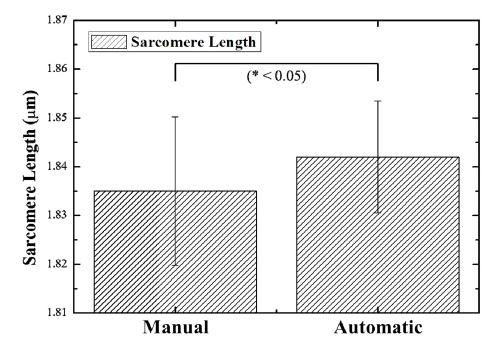
세포배양액의 상태에 따른 심근세포의 sarcomere 길이는 형광염색을 통해 측정되었다(Fig. 3). Well plate에 배양된 심근세포의 sarcomere 길이는 1.8±0.02 μm로 측정되었다. 2일주기로 수동으로 배양액을 교체한 심근세포는 1.83±0.015 μm, 배양액을 자동으로 교체한 심근세포는 1.84±0.01 μm의 sarcomere 길이를 측정되었다(Fig. 5). 수동 배양액 교체 세포의 배양액은 세포 활동에 의해 CO2 농도가 변화하고 자동 배양액 교체 세포는 pH가 유지되기 때문에 대조군에 비해 더 긴 sarcomere 길이를 측정되었다.
3.3 수축특성 변화
심근세포의 심장 박동수를 측정하기 위해 well plate에 세포배양 후 5~10일까지의 심장박동을 도립현미경을 사용하여 2분간 녹화하였고 ImageJ 프로그램을 이용하여 심장 박동수를 측정하였다. 수동 배양액 교체 심근세포는 배양액 교체전후 두 번측정하였고 자동으로 배양액이 교체되는 심근세포는 교체 중 한번을 측정하였다. Fig. 5는 배양액 상태에 따른 심근세포의 심장 박동수를 나타낸다. 수동 배양액 세포는 배양액 교체 직후 심장 박동수가 감소하였고 불규칙적인 심장 박동수를 보였다(Fig. 6(a),(b),(d)). 반면 자동으로 세포 배양액이 교체되는 심근세포는 대조군에 비해 조금 느리지만 일정한 심장 박동수를 측정하였다(Fig. 6(c),(d)). 자동 배양액 교체 세포는 배양액의 pH및 온도에 의한 심근세포의 shock이 대조군에 비해 적게 측정되었다.
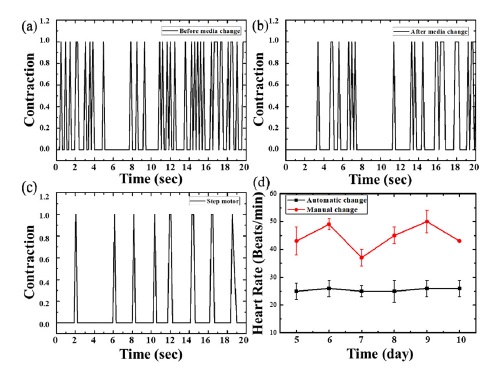
Heart rate of cardiomyocytes according to media condition; (a) before media change, (b) after media change, (c) continuous media change using step motor, (d) heart rate of cardiomyocytes
Table 2는 제작된 스텝모터 펌프를 사용하여 배양액을 지속적으로 공급 및 교체한 심근세포의 배양 후 7~10차 현미경 이미지를 나타낸다. 심근세포는 배양 후 7일차 세포 면적이 29.43%, 8일차 46.49%, 9일차 50.49%, 10일차 64.63%까지 증가하였다. 심근세포는 날짜가 지남에 따라 성장하였고 인접 세포와의 상호연결이 증가하였으며 10일차에서는 완벽히 동기화 되어 같은 주기로 수축 이완하는 것을 측정하였다.
4. 결 론
세포 배양액 교체 시 발생하는 심근세포의 shock을 줄이기 위해 지속적으로 배양액을 공급 및 교체하는 스텝모터 펌프시스템을 제작하였다. 스텝모터 펌프는 RPM을 조절하여 미세유량제어가 가능한 장점이 있다. 배양액의 장시간 pH 유지를 위해 펠티어 소자를 이용한 냉장고를 제작하였고 5~8oC의 온도 및 배양액의 pH는 7.39±0.15의 값을 유지하였다. 수축 이완하는 심근세포는 ImageJ 프로그램을 이용하여 심장 박동수를 측정하였고 스텝 모터 펌프를 이용하여 배양액을 지속적으로 교체하는 세포는 대조군 세포에 비해 일정한 심장 박동수를 측정하였다. 제안된 세포 배양액 자동 교체 시스템은 심근세포의 균일한 심장박동 및 수축력 향상을 보이며 유도 만능 줄기세포에서 분화된 심근세포를 사용하여 환자 맞춤형 약물 독성 평가가 가능할 것으로 기대한다.
Acknowledgments
This study was supported through a National Research Foundation of Korea (NRF) grant funded by the Korean government (MSIT) (No. 2017R1E1A1A01074550 and 2020R1A6A3A13076923).
REFERENCES
-
J. J. Norman, V. Mukundan, D. Bernstein, and B. L. Pruitt, “Journal Microsystems for Biomechanical Measurements”, Pediatr. Res., Vol. 63, pp. 576–583, 2008.
[https://doi.org/10.1203/PDR.0b013e31816b2ec4]

-
I. Itzhaki, L. Maizels, I. Huber, L. Z-Dantsis, O. Caspi, A. Winterstern, O. Feldman, A. Gepstein, G. Arbel, H. Hammerman, M. Boulos, and L. Gepstein, “Journal Modelling the long QT syndrome with induced pluripotent stem cells”, Nature., Vol. 471, pp. 225-229, 2011.
[https://doi.org/10.1038/nature09747]

-
J. Kramer, C. A. O-Paz, G. Myatt, Y. A. Kuryshev, A. BWright, J. S. Verducci, and A. M. Brown, “Journal MICE models: superior to the HERG model in predicting Torsade de Pointes”, Sci. Rep., Vol. 3, pp. 2100, 2013.
[https://doi.org/10.1038/srep02100]

-
T. Wang, N. Hu, J. Cao, J. Wu, K. Su, and P. Wang, “Journal A cardiomyocyte-based biosensor for antiarrhythmic drug evaluation by simultaneously monitoring cell growth and beating”, Biosens. Bioelectron., Vol. 49, pp. 9-13, 2013.
[https://doi.org/10.1016/j.bios.2013.04.039]

-
J. Michl, K. C Park, and P. Swietach, “Evidence-based guidelines for controlling pH in mammalian live-cell culture systems”, Commun. Biol., Vol. 2, pp. 144, 2019.
[https://doi.org/10.1038/s42003-019-0393-7]

-
A. T. Roe, M. Frisk, and W. E. Louch, “Targeting Cardiomyocyte Ca2+ Homeostasis in Heart Failure”, Curr. Pharm. Des., Vol. 21, No. 4, pp. 431-448, 2015.
[https://doi.org/10.2174/138161282104141204124129]

-
D. Peana and T. L. Domeier, “Cardiomyocyte Ca2+ homeostasis as a therapeutic target in heart failure with reduced and preserved ejection fraction”, Curr. Opin. Pharmacol., Vol. 33, pp. 17-26, 2017.
[https://doi.org/10.1016/j.coph.2017.03.005]

-
J. Yu, H. F. Zhang, F. Wu, Q. X. Li, H. Ma, W. Y. Guo, H. C. Wang, and F. Gao, “Insulin improves cardiomyocyte contractile function through enhancement of SERCA2a activity in simulated ischemia/reperfusion”, Acta Pharmacol. Sin., Vol. 27, No. 7, pp. 919-926, 2006.
[https://doi.org/10.1111/j.1745-7254.2006.00388.x]

- D. Li, J. Wu, Y. Bai, X. Zhao, and L. Liu, “Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy”, J. Vis. Exp., Vol. 87, pp. 51357, 2014.