탄소나노튜브 대면적 어셈블리를 통한 고감도-고선택성 과산화수소 센서 개발
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study presents a simple approach for the assembly of a free-standing conductive electronic nanofilm of single-walled carbon nanotubes (SWNTs) suitable for enzymatic electrochemical biosensors. A large-scale SWNT electronic film was successfully produced by the dialysis of p-Terphenyl-4,4´´-dithiol (TPDT)-treated SWNTs. Furthermore, Horseradish peroxidase (HRP) was immobilized on the TPDT-SWNT electronic film, and the enzymatic detection of hydrogen peroxide (H2O2) was demonstrated without mediators. The detection of H2O2 in the negative potential range (–0.4 V vs. Ag/AgCl) was achieved by direct electron transfer of heme-based enzymes that were immobilized on the TPDT-SWNT electronic film. The SWNT-based biosensor exhibited a wide detection range of H2O2 from 10 μM to 10mM. The HRP-doped SWNT electronic film achieved a high sensitivity of 342 μmA/mM·cm2 and excellent selectivity against a variety of redox-active interfering substances, such as ascorbic acid, uric acid, and acetaminophen.
Keywords:
Single-walled carbon nanotube, Hydrogen peroxide, Direct-electron-transfer, Enzymatic biosensor, Covalent assembly1. 서 론
1960년대 Clark 와 Lyons에 의해 효소 기반 바이오센서가 제안된 이후로, 다양한 산화 효소 (oxidase)가 적용된 전극이 개발되어 왔다 [1]. 바이오센서 시장에서 상업적으로 큰 성공을 거둔 포도당 센서의 경우, 당뇨병 환자의 혈당과 redox 반응이 가능한 glucose oxidase (GOx) [2]가 전기화학 측정 시스템에 적용되고 있으며, 그밖에 검출 목적에 따라 lactate oxidase [3], cholesterol oxidase [4], alcohol oxidase [5] 등의 다양한 효소가 바이오센서 시스템에 사용되고 있다.
Flavin-adenine dinucleotide (FAD)와 같은 산화환원 중심 (Redox center 또는 Redox cofactor)을 가지고 있는 산화 효소는 검출 대상 시료인 기질과 선택적·특이적 결합 시, 효소-기질 간의 반응 부산물로 과산화수소 (H2O2)를 형성하는데, 과산화수소의 농도를 정량 분석한다면 역으로 반응 물질의 농도를 측정할 수 있게 된다 [6].
전도성 소재로 이루어진 전극 상에 산화 효소가 고정화된 전기화학 바이오센서는, 효소와 기질 간의 반응 부산물이 전극 표면에 형성되고, 높은 과전압을 전극에 직접적으로 인가하여 과산화수소의 산화-환원을 유도함으로써, 전극과 과산화수소의 전기화학 반응 시 흐르는 전류를 직접적으로 측정한다 [6].
이러한 과산화수소와 전극 간의 heterogeneous electron transfer를 통한 농도 분석은 기존에 사용되어왔던 발광/발색법 (형광분광법[7], 화학 발광법[8] 및 UV-Vis 분광법[9])에 비해 시료 전처리가 필요 없고 상대적으로 측정이 간단하며 높은 재현성을 갖는다. 또한, 효소 전극 구조가 비교적 간단하여 스크린 프린팅 공법 등으로 고집적· 소형화 및 대량 생산이 가능한 장점이 있다.
1세대 전기화학 바이오센서 (The first generation electrochemical biosensor)의 경우 과산화수소와 전극 간의 산화-환원 반응 유도를 위해 인가되는 높은 과전압 (> 0.7 V vs. Ag/AgCl)이 생체 시료 속에 존재 하는 요산 (Uric acid, UA), 아스코르빅산 (Ascorbic acid, AA), 아세트아미노펜 (Acetaminophen, AP), 도파민 (Dopamine, DA) 등의 산화 또한 유발하기에, 전류 측정 시 과산화수소의 산화-환원 전류가 방해 물질의 산화 전류에 영향을 받는 문제점이 있다.
측정 전압 영역에서의 낮은 선택성 문제를 해결하기 위해 음전압 범위에, horseradish peroxidase (HRP)가 효소내 내부에 포함 하고 있는 heme moiety의 산화환원 변화를 과산화수소 검출 probe로 사용하는 3세대 전기화학 바이오센서가 고안되었다 [10].
HRP와 같은 metalloprotein의 heme moiety는 과산화수소와 효소-기질 반응 시 음전압 범위에서 heme moiety의 산화-환원 반응이 발생한다. 즉, 효소의 redox center (heme moiety)와 전극 간의 효율적 electrical pairing이 구현 된다면, 과산화 수소에 의한 redox center의 산화-환원 반응을 음전압 범위에서 전자직접주고받음 (Direct-Electron-Transfer, DET)으로 직접적으로 측정하기에, 높은 선택성을 확보 할 수 있다 [6].
비전도성 단백질로 둘러 쌓여 있는 효소의 redox center와 효율적 DET를 구현하기 위해 carbon nanotubes, metal nanoparticles, 2D nanomaterials등의 효소와 비슷한 aspect ratio를 가지면서 높은 전기 전도성· 전기 화학적 전하 전달 능력을 갖는 나노 소재의 사용이 보고되고있다 [11]. 하지만 전도성 나노소재를 사용하여 높은 재현성을 갖는 DET를 구현하기 위해서는 (1) 전도성 나노소재의 물리적/전기적 특성을 저하시키지 않으면서 대면적 소재를 형성해야 하며, (2) 효소 집적 시에 효소-나노 전극 소재 간의 전자 전달 효율을 감소시킬 수 있는 비전도성 바인더/크로스링커의 사용을 최대한 지양하여야 한다 [6,12].
본 연구에서는 효소와 높은 DET 효율을 가진다고 알려진 단일벽 탄소나노튜브 (single-walled carbon nanotube, SWNT)를 사용하여, SWNT 표면에 크로스링커 분자간의 π-π 결합을 통한 SWNT의 기능기화를 진행하고, 투석 공정을 적용하여 SWNT 상의 기능기 간의 결합을 유도하여 비파과적으로 대면적 SWNT 전자 필름을 제작하였다. 제작된 SWNT 전자 필름상에 HRP효소를 집적하여 과산화수소 주입 시 HRP-SWNT 하이브리드 필름의 전기화학적 특성을 조사하고, 선택성 및 감도 측정을 통한 과산화수소 바이오센서의 응용 가능성을 탐색하였다.
2. 연구 방법
2.1 시약 및 기기
SWNT는 NanoIntegris (USA)에서 SuperPureTube TM (25 mg/100 mL)을 구매하였으며, 포함된 불순물 제거를 위해 2% sodium cholate (SC, Sigma Aldrich, USA) 용액으로 3일간 buffer exchange를 진행하였다. HRP는 Toyobo enzymes (Japan)에서 구매하였으며, 과산화수소 및 p-Terphenyl-4,4´´-dithiol (TPDT), AA, UA, AP는 Sigma Aldrich에서 verth구입하였다. 투석공정은Spectra/Por (Spectrum Chemical Manufacturing Corp., USA) 멤브레인을 사용하였으며, 전기화학 실험은 Metrohm DropSens (Spain) 사의 250BT screen printed electrode를 사용하였다. 전기화학 분석은 Princeton applied research Versastat 3 (USA)를 이용하였으며, 저항 측정 및 면저항 측정은 HP 4156B (Agilent, USA)를 사용하여 측정하였다.
2.2 소재 제작 및 바이오센서 측정 방법
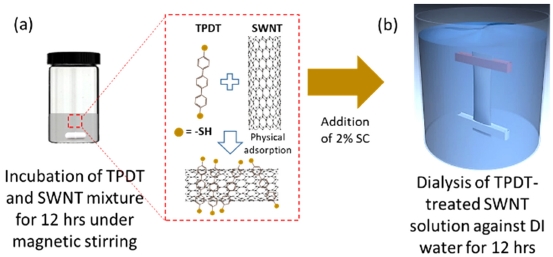
2% SC에 분산된 12.5 mg/100 mL SWNT 용액 800 μL를 500 μM의 TPDT 용액 200 μL와 혼합하여 상온에서 12 시간 교반하였다 (Fig. 1). TPDT처리된 SWNT 용액 1 mL를 2% SC 9 mL와 혼합한 후 투석 멤브레인에 주입하고, 3차 deionized water (DI water) 10 L로 12시간 투석하였다. 대조군 (negative control)은TPDT가 처리되지 않은 SWNT용액 800 μL와 2% SC 9.2 mL를 혼합하여 위와 같은 조건으로 투석을 진행하였다. 투석 공정 후 멤브레인 안쪽에 형성된 SWNT 전자 필름은 DI water가 채워진 플랜트 페트리 디쉬 (SPL Life Sciences, Korea)에 조심스럽게 꺼내어 보관하였다.
제작된 SWNT 전자 필름을 250BT 전극상에 전사하기 위해 작업 전극 (Working electrode, WE) 이외의 부분을 3M 테이프를 이용하여 마스킹 한 후, SWNT 전자 필름을 전극상에 전사 하였다. 제작된 SWNT 전자 필름이 건조된 후, 마스킹 테이프를 제거하고 10 mM phosphate buffer saline (PBS)에 준비된 60 mg/mL HRP용액 20 μL를 적하하고 2 시간 동안 효소 고정화를 진행하였다 (Fig. 2).
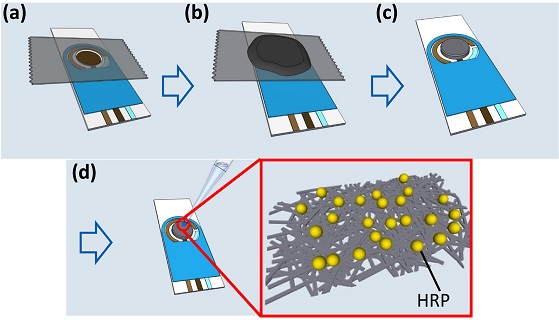
Schematic illustration describing the fabrication steps of a HRP/TPDT-SWNT biosensor. (a) Applying the masking tape for the selective deposition of the SWNT electronic film on the WE. (b) Transfer of TPDT-SWNT electronic film on the WE. (c) Masking tape removal. (D) HRP immobilization on the TPDT-SWNT film/WE. (Inset : HRP on the TPDT-SWNT electronic film).
HRP 효소가 집적된 TPDT-SWNT 과산화수소 센서의 성능 평가를 위하여, 10 mM PBS 환경에서 다양한 농도의 과산화수소 및 방해 물질을 주입하고, cyclic voltammetry (CV) 및 chronoamperometry 분석을 통해 음전압 범위에서 전기화학센서의 반응성 및 선택성을 조사하였다. SWNT 소재의 기능기화를 탐색하기 위해UV-Vis spectroscopy (Ocean optics, USA) 및 Energy dispersive X-Ray Spectroscopy (EDS, Jeol Ltd, Japan) 분석을 수행하였다. 또한 전자 필름의 미세구조 관찰을 위하여 SEM (Jeol Ltd, Japan) 표면 분석을 진행하였다.
3. 결과 및 고찰
TPDT가 표면 처리된 SWNT를 2% SC와 함께 투석 멤브레인에 주입하고 DI water를 대상으로 투석 공정을 진행하였다 (Fig. 1). 고농도 계면활성제에 분산된 TPDT-SWNT용액은 투석 멤브레인 밖의 DI water와의 concentration polarization으로 인해 [13] 높은 diffusion force를 받아 멤브레인 내벽 쪽으로 이동하게 된다. 하지만 투석 멤브레인의 molecular weight cutoff (MWCO)가 약 6-8 kD이기 때문에 계면활성제는 멤브레인 막을 투과하여 DI water쪽으로 이동하는 반면 SWNT는 투석 멤브레인을 투과하지 못하고 멤브레인 내부 막 부분에 집적된다 (Fig. 3).
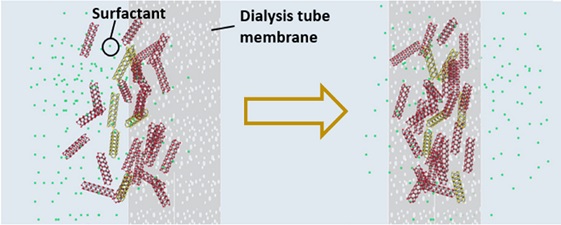
Schematic illustration describing the dialysis process of SWNT dispersed in the highly concentrated SC solution. After the dialysis, SC surfactants are phased out, while the SWNTs are accumulated inside of the dialysis membrane.
대조군으로 pure SWNT용액의 투석 공정을 진행하였을때 Fig. 4(a)에서와 같이 SWNT의 분산력 저하로 인해 전하 반발력이 감소하고, 이에 따라 π-π interaction [14]을 통한 SWNT 필름 조각이 형성됨을 확인할 수 있었다.
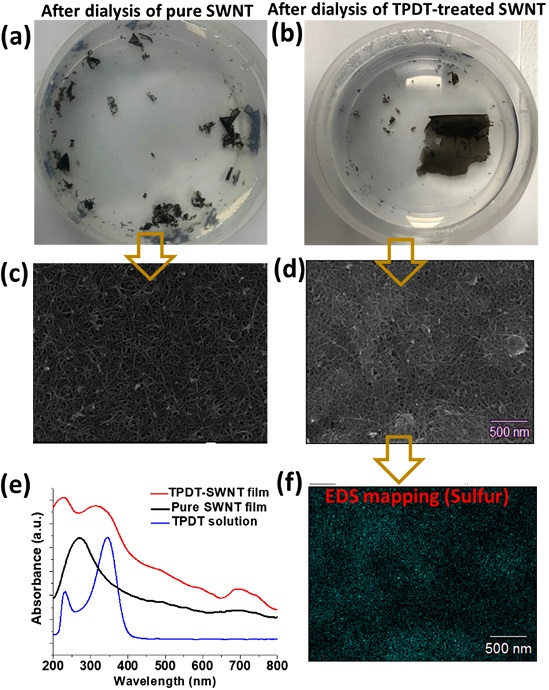
Optical and spectroscopic analysis of a SWNT electron film. (a, b) Optical images showing the result of dialysis process of pure SWNT and TPDT-treated SWNT, respectively. (c, d) SEM images of the electronic film fabricated with pure SWNT and TPDT-treated SWNT, respectively. (e) UV-Vis spectroscopic measurements of TPDT, pure-SWNT film, and TPDT-SWNT film. (f) EDS mapping of the TPDT-treated SWNT film in terms of sulfur.
Pure SWNT용액의 투석 공정 시 SWNT간의 약한 π-π interaction만이 assembly force로 작용하기 때문에 대면적 SWNT 형성이 어려운 반면 (Fig. 4(a)), TPDT-SWNT를 사용하여 투석 공정 시약 5 cm × 5 cm 크기의 대면적 SWNT 전자 필름을 성공적으로 합성할 수 있었다 (Fig. 4(b)). TPDT-treated SWNT를 이용하여 투석 공정을 진행 하였을 시, 멤브레인 내부 막 계면에 고농도로 집결한 TPDT-SWNT 입자는 주변SWNT간의 π-π interaction과 더불어 SWNT 표면에 non-destructively functionalized 된 thiol 간의 공유 결합 [15]을 통한 SWNT간의 glue effect가 추가적으로 도입되기에 대면적 어셈블리가 가능하였다.
Fig. 4(c, d)의 SEM 분석 결과 SWNT소재를 사용하여 어셈블리를 진행하면 높은 다공성 구조의 전자 필름이 형성됨을 알 수 있었다. Pure SWNT과 달리 TPDP-SWNT 필름은 전자 필름 상에 얇은 유기 필름이 형성되어 있는 것을 확인할 수 있었으며, 이는 SWNT상에 기능기화 된 TPDT 분자가 인접한 TPDT 분자 간의 화학 결합을 통하여 glue effect를 인가한 결과라고 생각된다. 대면적화 된 TPDT-SWNT 필름의 흡광도를 UV-Vis spectroscopy이용하여 측정한 결과, TPDP 분자의 흡광 peak인 230 nm와 350 nm peak가 TPDT-SWNT 전자 필름에서도 관찰되었다 (Fig. 4(e)). 또한, EDS mapping 분석 결과 TPDT-SWNT 필름에 황 원자가 포함되어 있는 것이 확인되었고 (Fig. 4(f)), 이는TPDT를 이용한 SWNT의 기능기화가 효율적으로 이루어졌음을 의미한다.
3.2 TPDT-SWNT 전자 필름의 전기화학적 특성 평가
투석 공정을 통하여 제작된TPDT-SWNT 전자 필름의 전기화학적 성능 평가를 위하여, free-standing TPDT-SWNT를 Screen printed Au electrode 상에 전사하여 전기화학적 특성을 평가하였다 (Fig. 5). 10 mM potassium ferrocyanide 용액 100 μL를 Bare Au electrode와 TPDT-SWNT가 집적된 Au 전극 (TPDT-SWNT/Au)에 각각 적하하여 -0.1 - 0.6 V vs Ag/AgCl 영역에서 전위를 주사하여 CV분석을 진행하였다.
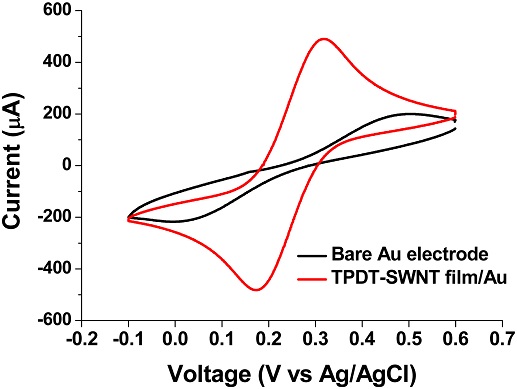
Cyclic voltammograms (CV) of 10 mM potassium ferrocyanide on a bare Au screen printed electrode (black line) and TDTP-SWNT/Au electrode (red line), respectively.
Bare Au 전극의 경우 Eo (= 0.24 V vs. Ag/AgCl) 대비 약 ± 250 mV의 과전압이 인가 되어야 peak current 에 도달 할 수 있으나, TPDT-SWNT 전자 필름이 집적된 Au 전극의 경우 TPDT-SWNT 필름의 코팅 만으로도 Quasi-reversible redox potential을 약 180 mV 감소시켰다 (Fig. 5) [16]. 또한, TPDT-SWNT 전자 필름 집적 시 redox peak current가 bare Au 전극 대비 143% 증가하였다. TPDT-SWNT 필름의 전기화학적 활성 증대는 투석 공법 기반의 비파괴적 어셈블리를 통해, 우수한 전기 전도성과 높은 전기화학적 활성을 갖는 SWNT소재의 고유 특성은 유지되면서 높은 표면적 및 기공성을 갖는 구조 형성으로 가능하였다고 사료된다 (Fig. 4(d)).
3.3 HRP/TPDT-SWNT 전자 필름의 특성 평가
TPDT-SWNT/Au 전극상에 과산화수소 분해 효소인 HRP를 고정한 후 효소 필름의 접촉각 C측정 및 UV-Vis 분석을 실시하였다.
TPDT-SWNT/Au 전극상에 과산화수소 분해 효소인 HRP를 고정한 후 효소 필름의 접촉각 측정 및 UV-Vis 분석을 실시하였다. 3 μl의 DI water를 적하한TPDT-SWNT 필름의 접촉각은 평균 68o 였으나, 효소 고정화 후 접촉각이 45o로 감소함을 알 수 있었다 (Fig. 6(a, b)). 이는 중성 용액에서 양전하 성을 띠는 HRP 효소가 SWNT 표면에 효율적으로 집적되었음을 보여준다. 또한 HRP효소가 집적된 HRP/TPDT-SWNT 필름과 효소 고정화 이전의TPDT-SWNT 필름의 UV-Vis spectra를 분석한 결과 효소 고정화 진행 후에 HRP/TPDT-SWNT 필름에서 약 405 nm 영역 흡광 밴드가 확인되었다 (red dotted line, Fig. 6(c)).
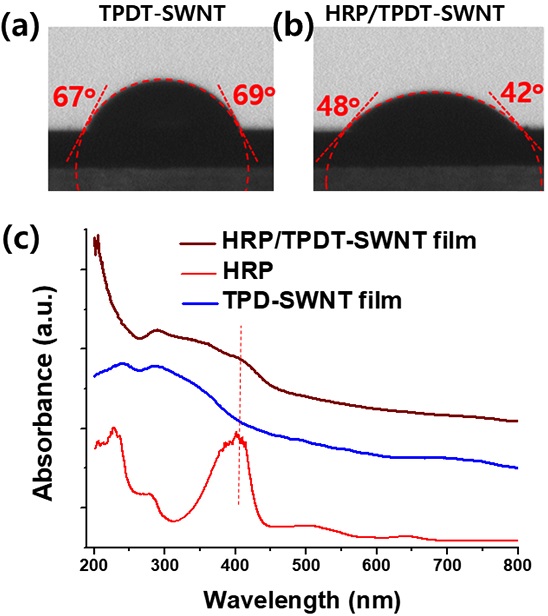
(a, b) Contact angle measurements before and after HRP immobilization on a TPDT-SWNT film, respectively. (c) UV-Vis measurements of the HRP/TPD-SWNT, TPD-SWNT, and HRP.
405 nm 밴드는 HRP/TPDT-SWNT 필름과 HRP에서만 확인되었고 TPDT-SWNT 필름에서는 관찰되지 않아 본 밴드는 HRP 효소에서 기인되었음을 유추할 수 있다. HRP효소는 약 404 nm 영역에서 높은 흡광 밴드가 확인되었는데, 이 흡광 밴드는 HRP 내부의 heme moiety에서 기인된 것으로 HRP 고정화가 TPDT-SWNT 상에 효율적으로 이루어졌음을 보여준다. 또한 고정화 전후의 band shift가 약 1-2 nm영역에서 이루어져 고정화 과정에서 HRP의 catalytic activity를 저하시킬 수 있는 효소의 conformational change가 최소화 되었음을 알 수 있었다 [17].
3.4 HRP/TPDT-SWNT 전자 필름의 전기화학적 특성 분석
HRP/TPDT-SWNT/Au바이오센서 전극의 전기화학적 특성 분석을 진행하였다. Fig. 7(a)는 HRP 효소가 집적된 전극에 –0.8 - 0.0 V vs. Ag/AgCl 전위를 주사 속도 별로 인가하여 산화-환원 전류 변화를 보여준다. 전위 주사 속도를 10 mV/s에서 4000 mV/s까지 증가하였을 때 약 -400 mV 영역에서 산화-환원 전류가 점차적으로 증가함을 확인할 수 있었다. -400 mV 영역에서 발생되는 산화 환원 전류는 TPDT-SWNT 상에 집적된 HRP의 heme moiety와 전극간의 DET로 인하여 발생되는 신호로서, 주사 속도 증가에 비례하여 산화/환원 전류의 peak current 값이 선형적으로 증가하였다 (Fig. 7(a) inset). 산화 환원 반응 물질의 전극으로 확산에 의한 주사 속도의 제곱근에 peak current가 비례하는 diffusion-controlled reaction과 달리, 주사 속도의 증가에 따른 선형적 산화환원 전류의 증가는 산화 환원 moiety가 전극과의electron tunneling 거리에 고정화되어 일어나는 surface-controlled reaction이며, 이는 HRP효소가 TPDT-SWNT 소재와 근접거리에서 전자직접주고받음 (DET)이 가능하다는 것을 보여 준다 [18]. 따라서 식 (1)에 표현된 Laviron’s equation을 통하여 전극과 산화환원 moiety간의 heterogeneous electron transfer rate constant (ks)를 계산하였다 [18].
| (1) |
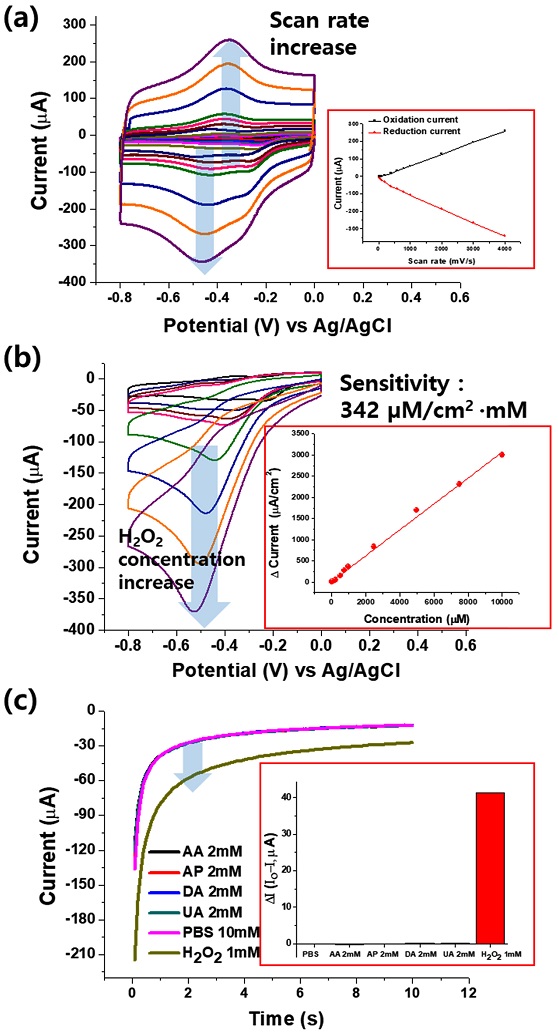
Electrochemical analysis of HRP/TPDT-SWNT/Au electrode. (a) CVs with various scan rates in 10 mM PBS solution. (b) A series of CV responses upon addition of hydrogen peroxide with different concentrations. (c) Chronoamperometry measurements in the presence of various interfering substances.
전하전달계수 (Charge-transfer coefficient) α = 0.5및 scan rate (ν)는 0.2 V/s으로 계산된 ks는 약 3.3 s-1으로 상대적으로 우수한 ks 값은 HRP와 SWNT 전자 필름 간의 효율적 electrical paring이 구현되었음을 보여준다.
HRP/TPDT-SWNT/Au바이오센서 전극 상에 다양한 농도의 과산화 수소를 주입하여 산화-환원 전류 변화를 모니터링하였다 (Fig. 7(b)). 과산화수소가 주입되었을 때 TPDT-SWNT 상의 HRP 효소와의 반응에 의해 환원 전류가 -0.4 - -0.6 V영역에서 증가함을 확인할 수 있었다. 과산화수소 주입 시 HRP가 효소 반응에 의해 과산화수소를 물로 환원시키고 자기 자신은 산화되며, 산화된 HRP는 전극에서 전자를 받아 다시 환원되어 초기상태로 돌아가게 되어 과산화수소 농도 증가 시 환원 전류가 증가하게 된다. 과산화수소 농도를 10 μM에서 10 mM 까지 점차적으로 증가 시켰을 때 환원 전류가 선형적으로 증가함을 확인하였으며 이때의 HRP/TPDT-SWNT 바이오센서의 감도는 약 342 μA/mM·cm2로 측정되었다.
음전압 범위에서 효소-기질 간의 선택·특이적 반응에 의한 산화 환원 전류 변화 측정이 주목받는 이유는, 다양한 방해 물질들이 수용액 상에서 약 0.2 - 1.2 V vs. Ag/AgCl 범위에서 산화 반응이 이루어지기 때문이다. 따라서 아스코르빅산, 요산, 도파민 등의 다양한 방해물질들의 열역학적 산화가 불가능한 0 V 이하 음전압 범위에서 DET기반의 전기화학 효소 센서 시스템이 구동 된다면, 측정하고자 하는 물질보다 상대적으로 높은 농도의 방해 물질 존재 하에서도 전기 화학 효소센서는 높은 선택성을 가지고 구동이 가능할 것이다 [6].
Fig. 7(c)는 -0.5 V 영역에서 다양한 방해 물질 존재 하에서 chronoamperometry 수행 한 결과로, 본 연구에서 선택한 방해 물질의 농도는 모두 2 mM로 제조 되었으며 1 mM의 타겟 물질인 과산화수소가 주입 되었을 때의 환원 전류 변화 대비 방해 물질 주입 시의 전류 변화를 상호 비교하였다. 1 mM 농도의 과산화수소 주입 시 약 40 μA의 환원 전류 증가가 확인되었으나, 두배 높은 다양한 방해 물질이 주입되었음에도 불구하고 전류 변화율은 모두 1% 이하로 확인되었다. 이는 본 연구에서 선택된 방해 물질 대부분이 0.2 - 0.8 V 사이의 영역에서 산화/환원 경향성을 갖는 반면에, HRP 효소의 DET는 -0.4 V 영역에서 구현되기에 방해 물질의 산화환원 준위와 약 600 mV의 전위 차이가 존재하게 된다. 따라서 방해 물질이 존재 함에도 불구하고 높은 선택성을 가지고 과산화수소의 농도 측정이 가능하다고 할 수 있다.
4. 결 론
본 연구에서는 thiol 기능기를 함유한 TPDT분자를 사용하여 비파괴적SWNT 기능기화를 진행하고, 투석 공정을 통해 대면적 SWNT 전자 필름을 제작하였다. 합성된 대면적 SWNT 전자 필름은 전자현미경 및 분광학 분석을 통해 구조 및 성분 분석을 진행하였다. TPDT-SWNT 대면적 전자 필름 상에 과산화수소 분해 효소인 HRP를 집적하여 전자직접주고받음 (DET) 기반의 과산화수소 센서로서의 응용 가능성을 탐색하였다. 높은 전기화학적 활성 및 전도성을 갖는 TPDT-SWNT 소재 상에 HRP를 집적하여 DET를 구현하였으며, 음전압 범위에서 높은 감도를 보였다. 이러한 음전압 영역에서의 DET 기반의 효소 센서는 분석 물질 보다 높은 방해 물질의 존재 하에서도 높은 선택성을 보였으며, 현재까지의 연구결과를 바탕으로 glucose oxidase, lactate oxidase 등의 redox cofactor 기반의 효소를 집적하여 다양한 DET 기반의 센서 플랫폼으로 발전이 가능할 것이라 사료된다.
Acknowledgments
이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.
REFERENCES
-
J. Wang, “Glucose biosensors: 40 years of advances and challenges”, Electroanalysis, Vol. 13, No. 12, pp. 983-988, 2001.
[https://doi.org/10.1002/1521-4109(200108)13:12<983::AID-ELAN983>3.0.CO;2-%23]

-
K. Tonyushkina and J. H. Nichols, “Glucose meters: a review of technical challenges to obtaining accurate results”, J. Diabetes. Sci. Technol., Vol. 3, No. 4, pp. 971-980, 2009.
[https://doi.org/10.1177/193229680900300446]

-
K. Hiraka, W. Tsugawa, and R. Asano, M.A. Yokus, K. Ikebukuro, M.A. Daniele, K. Sode, “Rational design of direct electron transfer type l-lactate dehydrogenase for the development of multiplexed biosensor”, Biosens. Bioelectron., Vol. 176, p. 112933, 2021.
[https://doi.org/10.1016/j.bios.2020.112933]

-
M. B. Gholivand and M. Khodadadian, “Amperometric cholesterol biosensor based on the direct electrochemistry of cholesterol oxidase and catalase on a graphene/ionic liquid-modified glassy carbon electrode”, Biosens. Bioelectron., Vol. 53, pp. 472-478, 2014.
[https://doi.org/10.1016/j.bios.2013.09.074]

-
M. Das and P. Goswami, “Direct electrochemistry of alcohol oxidase using multiwalled carbon nanotube as electroactive matrix for biosensor application”, Bioelectrochemistry, Vol. 89, pp. 19-25, 2013.
[https://doi.org/10.1016/j.bioelechem.2012.08.007]

-
S. W. Lee, K. Y. Lee, Y. W. Song, W. K. Choi, J. Chang, and H. Yi, “Direct electron transfer of enzymes in a biologically assembled conductive nanomesh enzyme platform”, Adv. Mater., Vol. 28, No. 8, pp. 1577-1584, 2016.
[https://doi.org/10.1002/adma.201503930]

-
X. Yu, Y. Gong, W. Xiong, M. Li, J. Zhao, and Y. Che, “Turn-on fluorescent detection of hydrogen peroxide and triacetone triperoxide via enhancing interfacial interactions of a blended system”, Anal. Chem., Vol. 91, No. 11, pp. 6967-6970, 2019.
[https://doi.org/10.1021/acs.analchem.9b01255]

-
M. P. Wymann, V. von Tscharner, D. A. Deranleau, and M. Baggiolini, “Chemiluminescence detection of H2O2 produced by human-neutrophils during the respiratory burst”, Anal. Biochem., Vol. 165, No. 2, pp. 371-378, 1987.
[https://doi.org/10.1016/0003-2697(87)90284-3]

-
C. C. Hsu, Y. R. Lo, Y. C. Lin, Y. C. Shi, and P. L. Li, “A Spectrometric method for hydrogen peroxide concentration measurement with a reusable and cost-efficient sensor”, Sens., Vol. 15, No. 10, pp. 25716-25729, 2015.
[https://doi.org/10.3390/s151025716]

-
Y. Y. Niu, J. Liu, W. Chen, C. X. Yin, W. J. Weng, X. Y. Li, X. L. Wang, G. J. Li, and W. Sun, “A direct electron transfer biosensor based on a horseradish peroxidase and gold nanotriangle modified electrode and electrocatalysis”, Anal. Methods, Vol. 10, No. 44, pp. 5297-5304, 2018.
[https://doi.org/10.1039/C8AY01980K]

-
I. S. Kucherenko, O. O. Soldatkin, D. Y. Kucherenko, O. V. Soldatkina, and S. V. Dzyadevych, “Advances in nanomaterial application in enzyme-based electrochemical biosensors: a review”, Nanoscale Adv, Vol. 1, No. 12, pp. 4560-4577, 2019.
[https://doi.org/10.1039/C9NA00491B]

-
S. W. Lee, T. H. Kang, S. K. Lee, K. Y. Lee, and H. Yi, “Hydrodynamic layer-by-layer assembly of transferable enzymatic conductive nanonetworks for enzyme-sticker-based contact printing of electrochemical biosensors”, ACS Appl. Mater. Interfaces, Vol. 10, No. 42, pp. 36267-36274, 2018.
[https://doi.org/10.1021/acsami.8b13070]

-
P. May, S. Laghmari, and M. Ulbricht, “Concentration polarization enabled reactive coating of nanofiltration membranes with zwitterionic hydrogel”, Membranes., Vol. 11, No. 3, pp. 187 2021.
[https://doi.org/10.3390/membranes11030187]

-
E. M. Perez and N. Martin, “π - π interactions in carbon nanostructures”, Chem. Soc. Rev., Vol. 44, No. 18, pp. 6425-6433, 2015.
[https://doi.org/10.1039/C5CS00578G]

-
D. Fass and C. Thorpe, “Chemistry and enzymology of disulfide cross-linking in proteins”, Chem. Rev., Vol. 118, No. 3, pp. 1169-1198, 2018.
[https://doi.org/10.1021/acs.chemrev.7b00123]

-
T. Pajkossy and S. Vesztergom, “Analysis of voltammograms of quasi-reversible redox systems: Transformation to potential program invariant form”, Electrochim. Acta., Vol. 297, pp. 1121-1129, 2019.
[https://doi.org/10.1016/j.electacta.2018.12.023]

-
J. L. Tang, J. G. Jiang, Y. H. Song, Z. Q. Peng, Z. Y. Wu, S. J. Dong, and E. K. Wang, “Conformation change of horseradish peroxidase in lipid membrane”, Chem. Phys. Lipids., Vol. 120, No. 1-2, pp. 119-129, 2002.
[https://doi.org/10.1016/S0009-3084(02)00109-3]

-
Z. P. Kang, K. L. Jiao, C. Yu, J. Dong, R. Y. Peng, Z. Q. Hu, and S. Q. Jiao, “Direct electrochemistry and bioelectrocatalysis of glucose oxidase in CS/CNC film and its application in glucose biosensing and biofuel cells”, RSC Adv., Vol. 7, No. 8, pp. 4572-4579, 2017.
[https://doi.org/10.1039/C6RA26636C]