가변 파장형 적외선 가스 센서에 의한 생체표지자 분석
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
In this study, biomarkers were analyzed and segmented using tunable infrared gas sensors after performing the principal component analysis. The free spectral range of the device under test (DUT) was around 30 nm and DUT-5580 yielded the highest output voltage property among the others. The biomarkers (isoprophyl alcohol, ethanol, methanol, and acetone solutions) were sequentially mixed with deionized water and their mists were carried into the gas chamber using high-purity nitrogen gas. A total of 17 different mixed gases were tested with three tunable infrared gas sensors, namely DUT-3144, DUT-5580, and DUT-8010. DUT-8010 resolved the infrared absorption spectra of whole mixed gases. Based on the principal component analysis with each DUT and their combinations, each mixed gas and the trends in increasing gas concentration could be well analyzed when the contributions of the eigenvalues of the first and second were higher than 70% and 10%, respectively, and their sum was greater than 90%.
Keywords:
Biomarkers, Tunnable infrared gas sensor, Fabry-Perot Interferometer, Principal components analysis, Eigenvalue1. 서 론
2016년도 국내 사망자의 사망원인 통계자료를 살펴보면 2015년도에 비해 4,932명 (약 1.8%) 증가한 상태를 나타내었다. 사망 원인별로 암의 사망자수가 가장 많았고, 심장질환, 뇌혈관질원, 폐렴, 자살(고의적 자해), 당뇨병, 만성 하기도 질환, 간질환, 고혈압성 질환, 운수 사고의 순이었다. 이들 10대 사망 원인은 전체의 69.5%를 차지한다고 보고하였다 [1]. 암에 의한 사망자 중 대장암은 국내외에서 제일 발생 비율이 높은 것으로 조사되었고, 대장암의 진단 [2]에는 분변 혈액 검출법(fecal occult blood test, FOBT), 결장 검사법(flexible sigmoidoscopy)의 대장 내시경 방법이 사용되고 있다. FOBT는 약 20% 이하의 감도와 18% 정도의 선별성을 갖는 것으로 발표되었으며, 대장 내시경은 75% 정도의 대장암 발병을 방지할 수 있음이 보고되고 있으나, 침습적 방법(invasive method)이라 비침습적 방법에 의한 진단이 요구되고 있다.
한편 장내 미생물의 변화가 체중의 변화와 밀접한 관계가 있음이 보고된 이후 [3], 장내 미생물의 생태계 변화는 1) 출생이후의 인슐린 분비의 약 70%를 담당하는 장내 호르몬인 Incretins의 증감을 유발하고, 2) 자가 면역제 역할을 담당하는 Butylate의 분비를 촉진 혹은 감소시킴으로써 장내 염증 조절의 기능을 담당한다고 추정하고 있다 [4]. 실제 임상 실험결과에서도 크론병(Crohn’s disease) 혹은 궤양성 대장염(ulcerative colitis)에 걸린 환자는 정상인에 비해 butyrate, acetate [5], methylamine, trimethylamine의 농도가 상대적으로 낮은 것으로 나타났으며 [6], 이들이 병인과 병증의 판단을 위한 생체표지자(biomarkers)로서의 역할에 대한 연구가 진행 중이다. 또한 음식물의 섭취와 소화 과정에서 다당류의 짧은사슬지방산(short chain fat acids)으로의 변환 과정에서 ethanol, acetic acid, acetone, isopropanol 등의 VOCs (volatile organic components)가 발생됨으로써, 이들이 각종 질환의 생체표지자 역할을 하고 있는 것으로 판단하고 있다 [7].
비침습적으로 각종 생체표지자 분석을 위한 전자코 (electronic nose)에 대한 의학적 관심과 적용이 증가되고 있으나, 이들은 산화물 반도체 혹은 폴리머를 이용한 형태 [8]이기에 주기적 보정과 장기 신뢰성의 문제를 야기할 수 있다. 그러나 상대적으로 신뢰성과 내구성이 우수한 것으로 평가되고 있는 가변 파장형광학식 가스센서의 적용 가능성이 발표되었으나 [9], 생체표지자에 대한 연구결과는 제시되지 않았다.
따라서 가변 파장형 광학식 가스 센서를 응용하여 생체표지자로 알려진 알코올 계열과 아세톤이 혼합된 액체에서 발생하는 혼합 가스를 측정하고, 이들의 측정 결과를 다변량 분석방법의 일환인 주성분 분석(principal component analysis)을 실시하여 각종 혼합 가스 상태를 분리 분석할 수 있는 가능성을 확인함으로써 비침습적 진단 방법으로서의 가능성을 제시하고자 한다.
2. 연구 방법
본 절에서는 이론적 고찰을 통해 가변 파장형 광학 필터의 동작 원리와 특성에 대해서 살펴보고, 주성분 분석(principal components analysis)의 의미와 수학적 연관성 및 실험 방법 등에 대해서 살펴보기로 한다.
2.1. 이론적 고찰
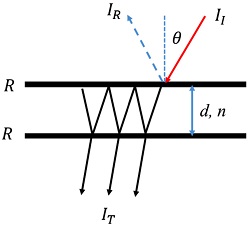
패브리-페롯 간섭계 (Fabry-Perot Interferometer, FPI)는 가변 파장형 광학식 가스 센서의 핵심 요소로서 기본적으로 Fig. 1의 구조를 갖는다.
간격 d를 갖는 두 개의 평행한 반사판 (mirrors)으로 구성된 FPI에 입사된 광(II) 은 상부 반사판에서 일부 반사(IR)와 흡수되고, 나머지 광은 반사판 사이를 공진한 후, 최종적으로 하부 반사판을 투과한다. 반사광은 경로차가 파장의 정수배 일 때 서로 상쇄됨이 이론적으로 알려져 있다 [10]. 또한 투과된 광 강도(IT)은 간격 d가 입사된 광 파장의 m 배일 때, 단 m은 정수, 최대 광 강도를 나타내는 것으로 알려져 있으며, 이들의 관계를 제시하면 아래와 같은 수식을 따른다 [10,11].
입사광의 투과율, 반사율과 흡수율의 합을 1이 되므로, 식 (1)과 같다.
| (1) |
반사판 표면에서의 위상 변화를 무시한 상태에서 근접한 광과의 광 경로 차이, δ는 식 (2)로 표현된다.
| (2) |
여기서 nf는 반사판의 굴절율(refractive index)를 의미하고, θ는 입사 각도, λ0는 입사광의 파장을 의미한다. 따라서 반사판에 수직하게 입사한 광의 경로차는 두 반사판의 거리와 입사 광파장, 그리고 반사판의 굴절율의 함수로 표현된다. 이들 중 nf는 반사판의 제조 과정에서 물리적 상수로 확정되고, 인위적으로 반사판 간의 거리, d를 조절하면 특정한 파장(λ0)의 경로차를 조절할 수 있고, 이에 따라 투과된 광 강도가 제어되어 원하는 파장만 통과하는 기능을 갖게 할 수 있게 된다.
한편 입사광에 대한 투과광의 광 강도 비는 식 (3)으로 표현되고,
| (3) |
식 (3)에서 투과 광 강도는 Airy 함수로 정의된 A(θ)가 1이 되는 경우 최대가 되고, 이 상태는 식 (2)의 광 경로, δ가 아래의 식 (4)를 만족하는 상태이다. 또한 식 (3)에 제시된 Airy 함수의 주기는 인접한 두 최대 광 강도 사이의 파장 차로 자유 파장 범위 (free spectral range)로 정의한다.
| (4) |
따라서 특정 파장(λ0)의 빛은 FPI의 반사판 사이의 간격 d를 조절함으로써 투과되고, 연속적인 광이 입사되는 광학계에서 FPI의 간격을 조절함으로써 원하는 파장의 광을 투과하게 할 수 있다.
주성분 분석은, 예를 들어 세개의 변수 x, y, z에 대해 각각 n개의 측정 결과가 있는 경우, 이들의 합성 변량 u = ax+by+cz와 구속 조건으로 a2+b2+c2= 1을 고려한다. 이때 합성 변량 u의 분산, 을 최대로 하는 계수, a,b,c를 구하고, 이들을 통해 주어진 자료의 특성을 파악하며, 그 의미를 분석하는 것으로 정의한다 [12].
주성분 분석에서 합성 변량을 통한 분산의 도출과 구속 조건을 대입한 연산은 결론적으로 분산과 공분산의 계산을 Lagrange 곱수법을 통하여 구하는 과정으로 귀결되며, 세 변수에 대한 문제는 아래의 식 (6)과 같은 분산과 공분산 행렬의 고유값과 고유벡터 구하는 것과 같다.
| (6) |
식 (6)에서 은 변수 x, y, z의 분산을 의미하고, sxy, sxz, syz은 변수 x와 y, x와 z, 그리고 y와 z간의 공분산을 의미한다.
식 (6) 의 풀이 과정을 통해 세 개의 고유값(eigenvalue)과 이들에 해당하는 고유벡터(eigenvector)가 도출되고, 해당 고유값, 예를 들어 최대 고유값 λ1, 의 고유벡터 a1, b1, c1에 의해 합성 변량, u1이 계산된다. 크기 순으로 구해진 고유값, λ1, λ2, λ3 는 합성 변량의 분산과 같은 값이고, 일반적으로 λ1, λ2가 전체 자료의 80% 이상을 대표하는 새로운 축 성분에 기여한다.
또한 전체 자료에서 각 변수들이 특정한 주성분에 기여하는 정도를 표현한 것을 성분 행렬 혹은 주성분 부하량(zpc)이라고 하는데 [13], 이는 식 (7)에 의해 주어지며, 이들을 기반으로 전체 자료의 특징을 간략하게 요약하여 특징을 파악할 수 있게 된다.
| (7) |
단, λ1, λ2 는 합성 변량의 분산이 최대가 되는 고유값, a1, a2는 각 고유값(λ1, λ2)에서 첫번째 변수(x)에 대한 고유벡터를 의미하며, 세 개의 변수를 갖는 자료의 경우, 세 쌍의 성분 행렬을 갖게 된다.
2.2. 실험과정 및 자료분석
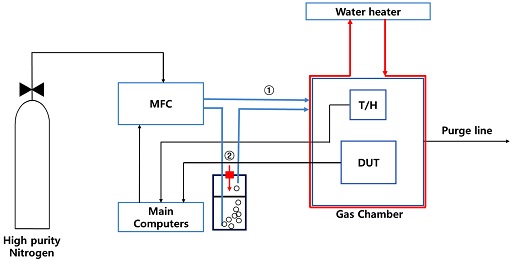
생체표지자를 분석하기 위한 기존의 연구들은 인체의 배설물인 소변과 대변 및 호흡기를 통해 배출된 가스를 사용하고 있다 [14]. 인체 배설물의 경우 인체와 유사한 환경에서 발효하여 발생된 가스를 분석하고 있다. 따라서 본 연구에서도 측정 환경을 인체 온도와 유사하게 설정하여 진행하였으며, 실험과 자료 확보를 위한 측정 시스템의 개략도를 제시하면 Fig. 2와 같다.
Fig. 2에 제시된 개략도에서 DUT (device under test)와 T/H(temperature/humidity sensor)는 stainless steel가스 챔버 내부에 설치하고, 가스 챔버의 외관은 일정한 온도 (약 38.5oC) 유지를 위해 온수가 흐르는 파이프로 감싸주었고, 그 구조는 기존 논문에 발표되어 있다 [15]. 본 연구에서 사용된 DUT-3044 혹은 DUT-8010은 적외선 센서 앞부분에 페브리-페롯 간섭필터가 장착되고, 외부에서 페브리-페롯 간섭필터에 인가되는 전압에 따라 적외선 센서에 도달하는 적외선의 파장을 30 nm 간격으로 3.0 μm에서 4.4 μm (DUT-3044) 혹은 8.0 μm에서 10.0 μm까지 조절할 수 있음을 의미한다.
각종 혼합 가스의 공급 전, DUT의 초기 출력 전압은 고순도 질소(99.9999%)를 첫번째 채널(①)을 통하여 DUT에 직접 공급한 상태에서 측정하였다. 이때 DUT의 온도변화를 방지하고자 유량은 1 liter/min으로 고정하였다. 혼합 가스는 용량 1.5 liter의 급수 여과기 필터에 1 liter 순수를 채우고, 주사기로 액체 공급 포트(②)에 IPA(Iso-propyl alcohol), ethanol, methanol과 acetone용액을 순차적으로 일정량 주입한 후, 고순도 질소 가스를 반송 가스 (carrier gas)로 주입하여 발생시켰다. 또한 각 혼합가스를 이용한 DUT출력전압 확인 전, 고순도 질소 가스를 가스 라인과 DUT 내부에 공급함으로써 VOCs (volatile organic components)가 없는 상태를 확보하였다. 각 가스에 대한 실험은 총 10회 반복하고, 그 평균값을 최종 분석에 이용하였다.
한편 측정 결과에 의한 주성분 분석 (principal components analysis, PCA)은 IBM®사의 다변량 분석 프로그램인SPSS-Version 25를 사용하였고, 추가적 자료 분석에 Sigma plot-12.5를 활용하였다.
3. 결과 및 고찰
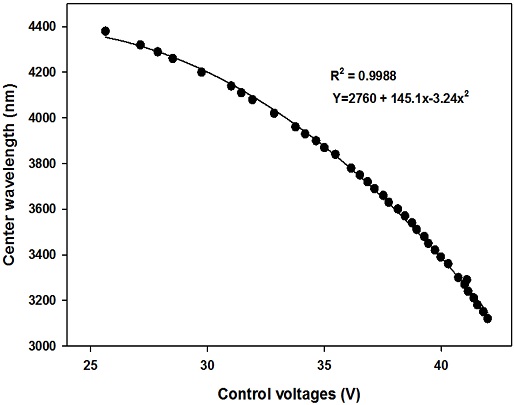
Fig. 3은 DUT 3144의 제어 전압에 따른 중심 파장 (center wavelength) 의존성 측정한 결과이다. 초기 상태는 약 35 V의 전압에서 중심파장 3900 nm를 나타내었다. 측정이 시작되면 제어전압은 42 V로 상승하여 중심파장 3120 nm를 갖도록 조절되고, 중심파장을 약 30 nm 증가시키기 위한 제어 전압을 정밀하게 감소시킨다. 제어 전압과 중심 파장의 관계는 Fig. 3에 제시된 바와 같이 2차함수로 표현되고, 제어 전압은 측정의 신뢰성을 확보하기 위해 약 300 ms 동안 유지되어 세 번의 측정이 가능하도록 설계 및 제작되어 있다.
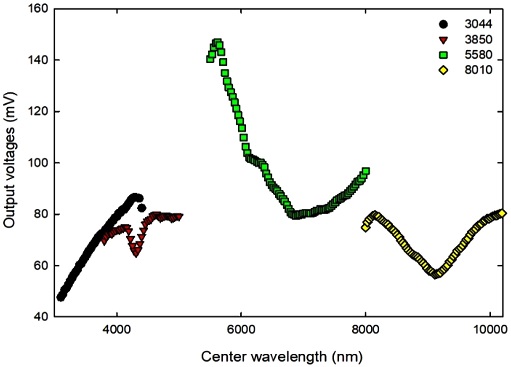
Fig. 4는 고순도 질소가스 상태에서FP-Filter가 장착된 DUTs의 중심 파장에 따른 출력전압 측정 결과를 제시한 것이다. 각 DUTs의 출력 전압은 중심 파장에 따라 고유한 출력전압을 갖고 있었고, DUT 3144와 3850의 중심 파장은 일부 중복되고, DUT-3850의 출력전압이 DUT-3144에 비해 낮은 특성을 갖고 있었다. 따라서 전체 실험 과정에서 DUT-3850을 이용한 특성 평가는 제외하였다.
Fig. 5는 세 개의 DUTs를 사용하여 혼합 가스 상태에서 측정한 출력 전압의 레이다 그래프 (radar plots)을 나타낸 것이다. Fig. 5의 모든 그림에서 DUT-3144의 출력 전압은 다른 두 DUTs의 출력 전압에 비해 미미한 값을 나타내고 있음을 볼 수 있다. Fig. 5(a)는 IPA 2 ml를 주입한 후와 IPA가 주입된 상태에 ethanol 1 ml 가 각각 주입된 상태의 혼합 가스에서 측정한 결과를 나타낸 것이다. 두 혼합 가스 상태에서 약 6.04와 6.64 μm 파장에서 최대 출력을 보여주고 있다. 또한 ethanol이 1 ml에서 18 ml로 주입량이 증가함에 따라 약 9.53 μm 파장에서 세번째 최대 출력을 갖는 피크가 나타나고 있음을 Fig. 5 (b)에서 볼 수 있다. 그리고 ethanol 18 ml가 포함된 용액에 methanol 을 5에서 15 ml 주입한 용액에서 방출된 혼합 가스로 인한 DUTs의 출력 전압을 Fig. 5(c)에 제시하였다. methanol 주입량이 증가함에 따라 피크 파장은 약 9.7 μm로 이동한 상태에서 출력 전압은 증가하였다. 모든 액체가 포함된 상태에서 acetone 5 ml를 주입한 상태에서의 출력 전압은 Fig. 5(d)와 같고, 최대 출력 전압은 5.98/6.7/7.36/8.21/9.65 μm 파장에서 나타났다. acetone이 첨가된 상태에서는 acetone의 적외선 흡수 파장인 7.36/8.21 μm에서 피크가 나타난 것을 재확인 할 수 있다. 그러나 Fig. 5 전체 측정 결과에서 DUT-3144의 출력 전압은 거의 관찰되지 않을 정도로 미약한 것으로 나타났다.
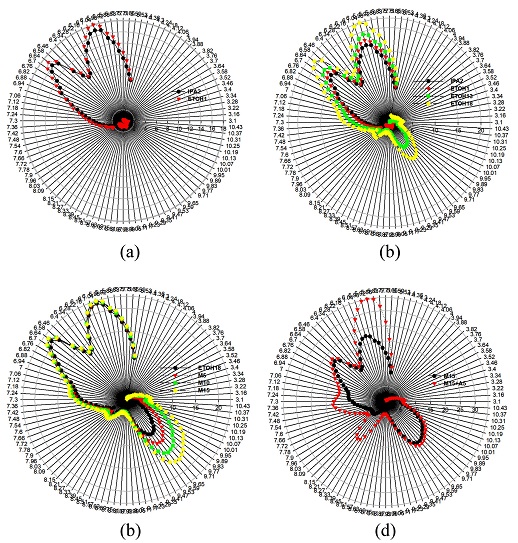
Radar plots of measured data with three DUTs ; (a) IPA 2 ml & ETOH 1 ml, (b) IPA 2 ml and ETOHs, (c) ETOH 18 ml and M5, M10, and M15, (d) M15 and M 15 with A5.
한편 각 DUT의 출력 전압으로 주성분 분석을 실시하였으며, 주성분의 고유값을 제시하면 Table 1과 같고, 성분 행렬의 요소에 따라 주성분 분석 결과를 제시하면 Fig. 6과 같다. 출력 전압이 작은 DUT-3144의 경우, 제1 주성분과 제 2 주성분 값들이 극명하게 분리되지 못하여 혼합 가스 내의 특정 가스를 분리하기가 어렵다는 것을 Fig. 6(a)로 확인할 수 있다. 그러나 상대적으로 출력 전압이 큰 DUT-5580, DUT-8010을 통한 주성분 분석은 각각의 가스를 정확하게 분리, 분석할 수 있었다. 또한 DUT-8010의 경우, 주입량의 변화 추이도 명확하게 확인할 수 있었다. 각 DUT의 측정 결과로 구한 고유값은 DUT-5580이 최대값인 λ1= 143.9와 λ2= 45.48로 계산되었음을 Table 1로 알 수 있다. 그러나 DUT-8010의 결과인 Fig. 6(c)의 이상점 (outlier, IPA-1)을 제외하면, DUT-8010이 각 가스들을 일정한 영역에서 분리하고 있음을 확인할 수 있었다.
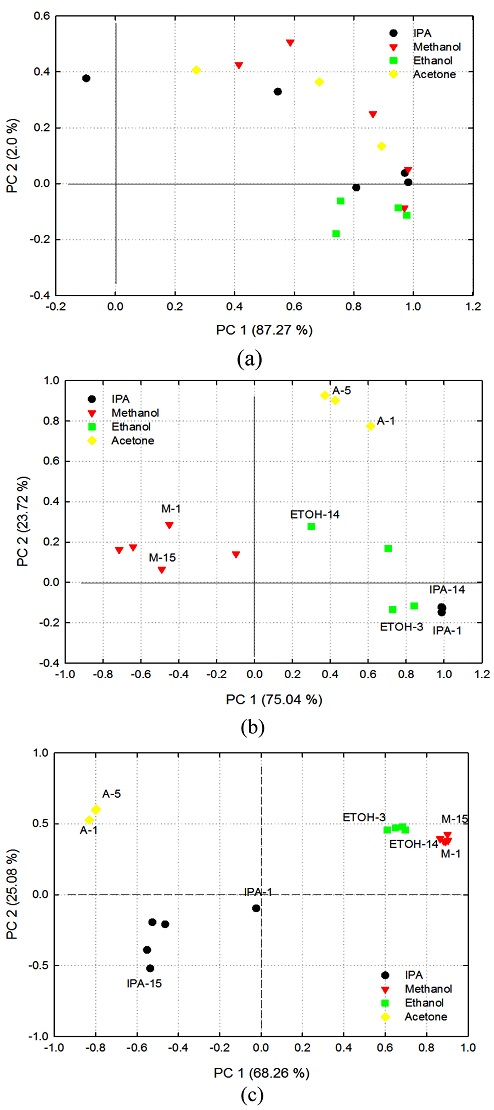
Principal components analysis of mixed gases with each DUT; (a) DUT-3144, (b) DUT-5580, (c) DUT-8010.
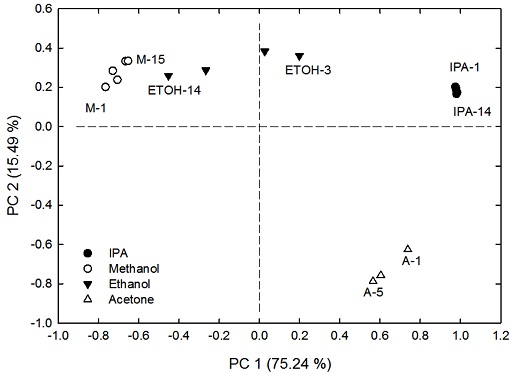
한편 Fig. 6과 Table 1 결과를 바탕으로 DUT의 조합에 의해 주성분 분석한 후, 고유값을 제시하면 Table 2와 같다. 출력 전압이 작고, 큰 DUT-3144와 DUT-5580의 결과를 조합한 주성분의 고유값은 240.01과 30.40을 나타냈다. 그러나 출력 전압이 제일 큰 DUT-5580과 중간치를 나타낸 DUT-8010의 조합은 205.81과 42.39로 계산되었다. 비록 DUT3144-5580의 고유값이 크지만, 이는 출력 전압이 작은 DUT와 큰 DUT에 의한 결과에 의한 것으로, Fig. 6(a)에서 볼 수 있듯 혼합 가스를 분리하는데 한계가 있다. 즉, 단순히 고유값이 크다는 것, 자료의 분산이 크다는 것, 만으로 주성분 분석 결과를 평가하기 어렵다는 것을 알 수 있다. 따라서 고유값도 크고, 혼합 가스 분리에도 무리가 없는 DUT-5580과 DUT-8010조합의 분석 결과를 제시하면 Fig. 7 과 같다.
분석결과 propane 계열인 IPA와 Acetone가스의 제 1 주성분은 1사분면과 4사분면에 각각 위치하여, dimethyl성분을 갖지만 수산화기를 갖는 IPA와 oxo group을 갖는 acetone을 분리한다. 반면methyl기 하나를 갖는 Ethanol, Methanol은 제 1 주성분을 중심으로 좌우로 구분·분포되고 있음을 알 수 있다. 즉, IPA와 Acetone은 제 1 주성분이 모두 양수인 경우이고, 수산화기 (OH)를 포함하는 경우, 제 2 주성분은 양수의 값을 갖게 됨을 알 수 있다. 또한 알코올의 농도가 증가함에 따라 제 1 주성분은 음수, 제 2 주성분은 양수를 갖는 경향을 갖고 있음을 알 수 있고, 가스 농도의 증가 경향도 확인할 수 있었다. 따라서 혼합된 가스를 분리 분석하고 농도 증가의 경향을 파악하기 위해서는 미세한 농도변화에도 큰 출력 전압 특성을 갖는 센서 시스템이 요구된다고 판단할 수 있고, 제 1 주성분과 제 2 주성분의 기여율합이 90% 이상인 경우, 자료의 특성을 잘 표현하게 됨을 알 수 있다.
본 연구 결과를 종합하면, 수산화기 (OH)를 포함하는 알코올 가스들은 비록 3.35-3.45와 9.38/9.85 μm 파장에서 적외선 흡수율이 크나, 약 9.65 μm에서 강한 적외선 흡수에 의해 큰 출력 전압 특성을 나타내고 있음을 알 수 있었다. 또한 기존 논문에 발표된 IPA, ethanol, methanol 및 acetone가스의 흡수 파장[3]과 다른 6.04/6.64 μm 파장의 피크가 검출된 것은 혼합 액체에서 발생된 혼합 가스 분석이라는 본 연구 결과 상의 특이 사항이라 할 수 있다.
17개 변수를 종합하여 주성분 분석을 진행하고, 이를 통해 측정 자료를 대표할 수 있는 성분을 도출하고자 하였다. 이론적으로 제 1 주성분의 고유값이 클수록 한 축 상에 측정 자료의 특성을 명료하게 분리할 수 있을 것으로 예상할 수 있으나, 제 1주성분 고유값과 제 2 주성분 고유값 기여율의 합이 90% 이상인 결과가 가장 좋은 결과를 나타내었다. 또한 고유값이 크고, 상대적으로 비슷한 주성분의 기여율을 갖는 소자를 조합하여 주성분 분석을 한 결과 17가지 혼합 가스 상태를 가장 우수하게 분리하고, 분석할 수 있음을 확인할 수 있었다.
4. 결 론
본 연구에서는 FPI 필터를 갖는 적외선 센서의 특성을 파악하고, IPA, ethanol, methanol, acetone 용액의 혼합비에 따라 발생된 17가지 혼합 가스 상태에 대한 주성분 분석을 실시하였다.
연구에 사용된 적외선 센서는 30 nm 간격으로 중심 파장을 조절할 수 있었고, DUT-3144와 DUT-3850의 측정 범위와 출력 전압 특성의 유사성을 갖고 있었다. DUT-3144의 출력 특성은 DUT-5580과 DUT-8010에 비해 작은 값을 갖고 있었고, 주성분 분석 결과 가장 작은 고유값을 나타내었다. 반면 DUT-5580과 DUT-8010이 순차적으로 큰 고유값을 갖고, 17가지 혼합 가스를 분리할 수 있음을 알 수 있었다.
이론적으로 분산을 최대화한 조합이 혼합 가스 상태를 가장 잘 분리할 수 있을 것으로 기대하였으나, 출력 전압 특성이 큰 DUTs를 이용한 주성분 분석이 가스 종류와 농도의 증가 경향도 분석할 수 있음을 확인할 수 있었다.
따라서 인체 배설물에서 배출되는 미소 농도의 생체 표지자(biomarkers) 분석을 위해서는 출력 특성을 향상시킬 수 있는 신호처리 회로의 설계와 적용이 필수적이라 할 수 있다.
Acknowledgments
본 연구는 2018년도 한국연구재단의 지원 (No.2018R1D1A3B07047542)과 2020년도 한국교통대학교 지원을 통해 수행된 결과이다.
REFERENCES
- https://www.cancer.go.kr, (retrieved on Dec. 20, 2017)
-
K. K. F. Tsoi, S. S. M. Ng, M. C. M Leung, and J. J. Y. Sung, "Cost-effectiveness analysis on screening for colorectal neoplasm and management of colorectal cancer in Asia", Aliment Pharmacol Ther., Vol. 28, No. 3, pp. 353-363, 2008.
[https://doi.org/10.1111/j.0269-2813.2008.03726.x]

-
R. E. Ley, P. J. Turnbaugh, S. Klein, and J. I. Gordon, “Human gut microbes associated with obesity”, Nature, Vol. 444, pp.1022-1023, 2006.
[https://doi.org/10.1038/4441022a]

-
A. Vrieze, F. Holleman, E. G. Zoetendal, W. M. de Vos, J. B. L. Hoekstra, and M. Nieuwdorp, "The environment within how gut microbiota may influence metabolism and body composition", Diabetologia, Vol. 53, No. 4, pp. 606-613, 2010.
[https://doi.org/10.1007/s00125-010-1662-7]

-
D. Monleón, J. M. Morales, A. Barrasa, J. A. López, C. Vázquez, and B. Celda, "Metabolite profiling of fecal water extracts from human colorectal cancer", J. NMR Biomed., Vol. 22, No. 3, pp. 342-348, 2008.
[https://doi.org/10.1002/nbm.1345]

-
J. R. Marchesi, E. Holmes, F. Khan, S. Kochhar, P. Scanlan, F. Shanahan, I. D. Wilson, Y. Wang, "Rapid and noninvasive metabonomic characterization of inflammatory bowel disease", J. Proteome Res., Vol. 6, No. 2, pp. 546-551, 2007.
[https://doi.org/10.1021/pr060470d]

-
P. Louis and H. J. Flint, "Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine", FEMS Microbiol. Lett., Vol. 294, No. 1, pp. 1-8, 2009.
[https://doi.org/10.1111/j.1574-6968.2009.01514.x]

-
S. W. Brooks, D. R. Moore, E. B. Marzouk, F. R. Glenn, and R. M. Hallock, "Canine olfaction and electronic nose detection of volatile organic compounds in the detection of cancer: a review", Cancer Invest., Vol. 33, No. 9, pp.411-419, 2015.
[https://doi.org/10.3109/07357907.2015.1047510]

-
N. Neumann, M. Ebermann, S. Kurth, and K. Hiler, “Tunnable infrared detector with integrated micromachined Fabry-Perot filter”, J. Micro/Nanolith. MEMS MOEMS, Vol. 7, No. 2, pp. 021004(1)- 021004(13), 2008.
[https://doi.org/10.1117/1.2909206]

- E. Hecht, Optics, 1 Lake St., Addison-Wesley Longman, NJ, pp. 409-418, 1998.
-
J. H. Jerman, D. J. Clift, and S. R. Mallinson, “A miniature Fabry-Perot interferometer with a corrugated silicon diaphragm support”, Sens. Actuators A, Vol. 29, pp. 151-158, 1991.
[https://doi.org/10.1016/0924-4247(91)87117-L]

- H. J. No, Principal component analysis & factor analysis, Hanol, Seoul, pp.4-109, 2014.
- H. J. No, Principle of multivariable analysis and exercises using Excel and SPSS, Hanol, Seoul, pp. 397-412, 2010.
-
W. Filipiak, P. Mochalski, A. Filipiak, C. Ager, R. Cumeras, C. E. Davis, A. Agapiou, K. Unterkofler, and J. Troppmair, “A compendium of volatile organic compounds (VOCs) released by human cell lines”, Curr. Med. Chem., Vol. 23, No. 20, pp. 2112-2131, 2016.
[https://doi.org/10.2174/0929867323666160510122913]

- S. H. Yi, J. S. Kim, and S.U. Yi, “Analysis of biomarkers using optical electronic nose”, J. Sens. Sci. Technol., Vol. 28, No. 3, pp. 171-176, 2019.