소 혈청 알부민의 금 표면 플라즈몬 공명 칩과의 반응에 대한 pH의 영향
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Reactions between gold (Au) surface plasmon resonance (SPR) chips and bovine serum albumin (BSA) dissolved in solutions of different pH were investigated. The charge on the BSA depends on the pH of the solution in which it is dissolved. Thus, dissolving BSA in different pH solutions resulted in different charges of BSA. Among the BSA dissolved in solutions with pH 4.01, 7.4, and 10.01, the SPR response was the highest for BSA dissolved in the solution of pH 4.01. To eliminate the response variation owing to the difference in the refractive indices of the solutions, phosphate buffered saline (PBS) was injected into the system after the reaction of BSA with the Au SPR chip had happened. In this case too, the BSA dissolved in the solution with pH 4.01 exhibited the highest response. This may be attributed to the non-uniform distribution of ionic patches on the BSA, which can induce electrostatic attraction to the surface even though BSA has a positive charge at pH 4.01, and the absolute values of the net charge of BSA at pH 4.01 and 7.4 were very close.
Keywords:
Charge, Isoelectric point, Surface plasmon resonance, Bovine serum albumin, Gold, pH1. 서 론
최근 수 십년 동안 표면 플라즈몬 공명(surface plasmon resonance, SPR) 기반의 센서가 많은 관심을 받았다 [1-3]. 이런 SPR 기반의 센서를 의료용, 환경용, 식품용 등에 활용하기 위한 연구가 많이 이루어져 왔다 [3-6]. SPR 기반의 센서는 기본적으로 굴절률의 변화를 감지하는 센서라고 할 수 있다. 빛의 속력이 매질에 따라 달라지는 특성인 굴절률은 진공 속에서 빛의 속력을 어떤 매질 속에서의 빛의 속력으로 나눈 값으로 정의된다 [7]. 일반적으로 특정 매질에서의 굴절률은 빛의 파장에 따라 조금씩 변하기도 한다 [7]. 만약 일정한 파장을 가진 빛이 어떤 매질로 입사될 때 굴절률이 변화하였다면, 그 현상은 바로 그 어떤 매질의 물질이 변하였다고 할 수 있다.
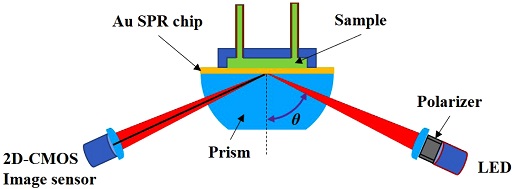
가장 일반적인 형태의 SPR 센서 시스템은 Kretschman 배치(configuration) 형태이며, 이를 그림 Fig. 1에 나타내었다. 굴절률이 높은 매질에서 굴절률이 낮은 매질로 빛이 입사할 때 임계각 이상의 각으로 빛이 입사되면 전반사가 일어난다. 이런 임계각 이상의 각으로 p-편광된 빛이 입사되면 금속 박막에서 거울처럼 빛이 반사되는 것이 일반적인데, 특정 입사각에 가까워지면 반사광의 강도가 차츰 약해지고, 반사광의 강도가 최대로 낮아졌다가 다시 서서히 증가하게 된다 (Fig. 3). 반사광의 강도가 가장 낮을 때의 입사각을 공명각이라 한다. Kretschman 기반의 SPR 시스템은 프리즘(prism) 바로 위에 금속 박막을 증착(deposition)하거나 매칭 오일(matching oil)을 프리즘 위에 떨어뜨려 SPR 칩과 밀착시키기 때문에 금속 박막의 한 쪽은 프리즘으로 고정된 상태가 된다. 따라서, SPR시스템은 금속 박막에서 프리즘 쪽이 아닌 그 반대쪽에 존재하는 매질의 변화에 따라 굴절률의 변화를 감지하게 된다. 이에 따라 ‘반사광 강도-입사각’ 관계 그래프인 반사도 곡선(reflectance curve)에 변화가 발생한다. 반사도 곡선의 변화는 반사도 곡선의 이동을 유발하고, 이에 따라 공명각의 변화가 발생한다. 즉, 공명각의 변화를 관찬하면 매질의 굴절률의 변화를 추측하며, 이를 통해 매질 속의 측정 대상 물질(target)의 정성적 또는 정량적 변화를 유추할 수 있다.
본 연구에서는 특정 단백질을 이용하여 단백질의 대전된 상태에 따라 SPR 시스템의 반응 특성을 조사하였다. 일반적으로 단백질은 산성 또는 염기성 잔기의 상대적 함량에 기초하여 전기적 극성을 띠게 되는데, 단백질의 순 전하(net charge)가 0인 pH값을 등전점(isoelectric point, pI)이라 일컫는다 [8]. 본 연구에 사용한 모델 단백질은 소 혈청 알부민(bovine serum albumin, BSA)으로 인간의 혈액에서 관측되는 단백질 중 가장 많이 나타나는 단백질인 알부민 단백질과 매우 유사하다[9]. 또한 BSA는 높은 안정성, 고순도 가용성 및 수용성으로 인해 많은 연구에 사용되어 왔다 [10]. 이러한 BSA의 등전점은 pH 4.5-5.0으로 중성 용액(약 pH 7-7.4)에서는 전체 분자로서 음전하를 띠고, pI보다 낮은 산성 조건에서는 양전하를 띠게 된다 [9,11]. 본 연구에서는 SPR 현상이 일어나는 상황에서 대상 물질(target substance)의 대전 상태(charged state)에 따라 금(gold, Au) SPR 박막 칩에 반응하는 정도를 알아보는 실험을 진행하였다. 이를 위해 모델 단백질인 BSA를 pH 4.01, 7.4, 그리고 10.01에 용해시켜 BSA 단백질의 대전 상태에 변화를 유도하였고, 이를 SPR 장치에 주입하여 다양하게 대전된 BSA 단백질과 Au SPR 칩과의 반응을 관찰하였다.
2. 실험 방법
2.1 SPR 시스템
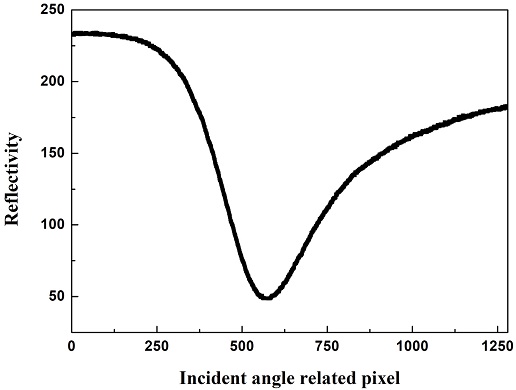
본 연구에 사용한 SPR 시스템은 이전 연구 [12]에서 사용한 시스템과 동일하게 구성되어 있으며, 계략도를 Fig. 1에 나타내었다. 광원으로는 770 nm의 파장을 피크(peak)로 하는 light-emitting diode(LED: Opnext Inc., Japan)를 사용하였다. LED에서 나온 광은 band pass filter(770 ± 10 nm)와 편광판을 지나 p-편광된 쐐기 빔(빔의 범위: 약 7°) 형태로 원통형 모양의 프리즘(BK-7)에 입사된다. 이렇게 입사된 광은 프리즘 위에 있는 Au SPR 칩(Au(48 nm)/Cr(2 nm)/BK-7 glass)에 의해 반사된다. 반사된 반사광은 2-dimensional complementary metal-oxide semiconductor (2D-CMOS: 1,280 "~ 1,024 pixels, IDS Co., Germany) 이미지 센서에 도달하게 된다. 2D-CMOS이미지 센서를 통해 얻은 사진은 Imgae J[13] 소프트웨어를 이용하여 회색톤(greyscale)을 기반으로 입사각-반사광의 강도 관계를 나타내는 반사도 곡선을 얻을 수 있다. Fig. 2는 기준점(baseline)을 설정하는데 사용한 phosphate buffered saline (PBS) 용액에 대한 2D-CMOS 이미지 센서를 통해 얻은 사진이다. 이때 쐐기 빔의 중심각은 66.5°이다. Fig. 3는 Fig. 2에 나타난 3개의 채널(channel) 중 가운데 채널에 관심 영역(region of interest, ROI: Fig. 2의 사각형 영역)을 설정하여 입사각에 대한 반사광 강도인 반사도 곡선을 Image J를 이용해 얻은 그래프를 보여주고 있다. 이미지에서 어두운 부분, 즉 반사된 빛이 약한 부분이 반사도 곡선에서 아래로 내려가는 영역이 되고, 가장 어두운 곳이 바로 반사도 곡선에서 가장 낮은 반사광의 크기를 가지게 되며, 이에 해당되는 입사각이 공명각이 된다.

Image acquired from 2D-CMOS image sensor at the center angle of incident beam of 66.5° with PBS in channels.
2.2 실험 방법
측정을 시작하기 전, SPR 칩은 60-70oC의 piranha용액(H2SO4(황산):H2O2(과산화수소수)=4:1) 안에 20분간 담구어 세척을 진행하고 초정수를 이용하여 씻어낸 다음, 바로 그 칩들을 차례로 아세톤, 메탄올, 초정수 용액들에 담구어 3분간 초음파 세척을 진행하였다. 이후 N2 가스를 이용하여 건조하였다.
pH 4.01과 10.01 buffer 용액에 용해된 BSA에 대한 SPR 반응을 측정하는데 있어, PBS 용액(pH 7.4)에 용해된 BSA의 반응과 비교하기 위해 먼저 PBS 용액을 SPR 센서 시스템에 주입하여 기준선을 잡았다. 그 다음 용매로 사용한 BSA가 용해되지 않은 pH 4.01과 10.01 buffer용액을 주입하였다. 그리고, BSA가 용해된 pH 4.01과 10.01 buffer용액을 주입하여 반응을 관찰하였다. 다음으로 표면과 반응하지 않은 BSA를 제거하기 위해 용매로 사용된 pH 4.01과 10.01 buffer용액을 다시 주입하였다. 마지막으로 용매의 굴절률 차이에서 나타나는 변화적 요인을 제거하기 위해 PBS용액을 주입하여 각각 다른 pH 용액에 용해된 BSA가 SPR과 반응한 값들을 같은 조건에서 비교하고자 하였다.
본 실험에 사용된 BSA 단백질은 Sigma-Aldrich제품을 사용하였으며, 단백질을 희석할 때 사용한 PBS 용액은 gibco (Life technology Corporation) 제품을 사용하였다. 또한 pH 4.01(H2O, C8H5O4K)과 10.01(H2O, Na2CO3, NaHCO3, C8H8O3) buffer 용액은 Thermo Scientific 제품을 사용하였다.
3. 결과 및 고찰
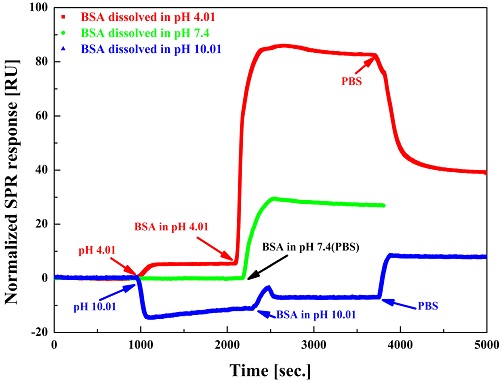
Fig. 4는 다른 값을 가진 pH 용액들에 용해된 BSA의 Au SPR 칩에 대한 반응을 나타내는 SPR sensorgram이다. 모든 실험에서 PBS용액을 주입하여 안정된 상태가 되면 이를 기준선으로 정하였다. Fig. 4에서는 서로 다른 pH용액들(pH 4.01, pH 7.4 그리고 pH 10.01)에 용해된 BSA 와 Au SPR 칩과의 반응을 용이하게 비교하기 위해 기준선을 0이 되도록 규격화(normalized)하였다. SPR response는 SPR 공명각의 변화를 측정한 값으로, 공명각의 변화는 2D-CMOS 이미지 센서 사진들의 가장 어두운 곳의 pixel값 변화로 측정하였다. 이 실험에서는 입사각 1° 변화에 대한 pixel 값의 변화는 200 pixel로 나타난다. Fig. 4에 나타난 사각형(빨간색) 기호들은 pH 4.01에 용해된 BSA와 Au SPR 칩과의 반응을 시간에 따라 나타낸 것이다. PBS용액을 주입하여 기준선을 잡고, 그 다음 BSA 단백질이 용해된 pH 4.01과 동일한 단백질이 용해되지 않은 pH 4.01을 주입하면 Fig. 4에서 보는 바와 같이 변화가 나타나는데 이는 용액이 바뀌어 굴절률이 변하였기 때문이다. pH 4.01을 약 20분 정도 흘려 측정한 다음, 1 mg/ml 농도의 BSA가 용해된 pH 4.01(부피: 200μl) 용액을 주입하면 상당히 큰 변화가 발생하는 것을 알 수 있다. 그 다음 BSA가 용해되지 않은 pH 4.01 용액을 다시 20분 정도 주입하여 반응하지 않은 BSA를 표면으로부터 제거할 수 있다. 그 후 실제 pH 4.01에서 BSA와 Au SPR 칩과의 반응을 측정하였다. 그리고, BSA가 용해된 용매가 다르면 굴절률이 달라 측정값이 달아진다. 비교 측정을 위해 기준선과 동일한 용매인 PBS를 그 다음으로 주입하여 반응을 측정하였다. Fig. 4에서 보는 바와 같이 PBS를 주입하면 sensorgram의 반응 값이 낮아지는 것을 볼 수 있다. 이는 Au SPR 칩에 결합된 BSA가 탈착되었다기보다는 굴절률의 변화로 그 반응 값에 변화가 발생한 것으로 판단된다. 이는 BSA와 Au SPR칩과의 반응을 한 후 PBS 용액 안에서 측정한 값을 보면 기준선과 차이가 발생했다는 것을 알 수 있다. Fig. 4에 나타난 동그라미(초록색) 기호들은 pH 7.4인 PBS에 용해된 BSA가 Au SPR 칩과의 반응을 시간에 따라 나타낸 것이다. 이 실험은 기준선과 비교를 위해 사용되는 PBS와 동일한 용매를 사용하여, BSA와 Au SPR 칩과의 반응을 측정하기 위해서 처음에 PBS로 기준선을 잡은 그 다음에 BSA 용해된 PBS를 주입하였다. 그 다음 다시 동일 용매인 PBS 를 주입하여 반응하지 않은 BSA를 씻어낸 다음 반응 변화를 측정하였다. pH 10.01에 용해된 BSA가 Au SPR 칩과의 반응을 관찰하기 위해서는 pH 4.01에 용해된 BSA가 Au SPR 칩과의 반응을 관찰하기 위해 진행한 실험 방법과 동일한 방법을 사용하였다. 이 실험 결과는 Fig. 4의 삼각형(파란색) 기호로 나타나 있다. Fig. 4에 보는 바와 같이pH 10.01을 주입하면 굴절률의 변화가 반응 값이 낮아지는 특성을 보이며, 이것이 pH 4.01을 주입하였을 때와의 기본적인 차이이다.
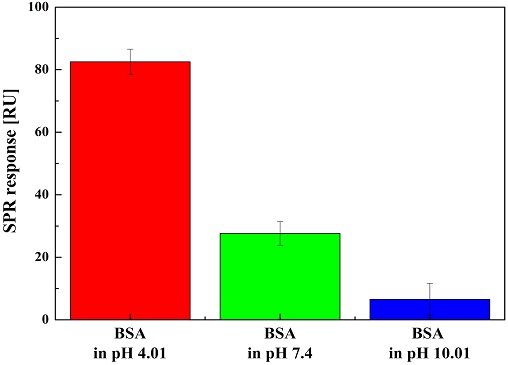
위에서 언급한 실험을 동일한 방법으로 3회 진행하였으며, Table과 막대 그래프를 활용하여 그 측정값과, 이들의 평균 및 표준편차를 기록하였다. pH 4.01, pH 7.4, 그리고 pH 10.01에 용해된 BSA의 Au SPR 칩에 대한 반응 값들, 그리고 그 들의 평균 및 표준편차를 Table 1에 나열하였고, 비교를 용이하게 하기 위하여 Fig. 5 막대 그래프를 이용하였다. Table 1과 Fig. 5에서 보는 바와 같이 pH 4.01에 용해된 BSA가 Au SPR 칩과 가장 많이 흡착되었고, 그 다음으로 pH 7.4, 그리고 pH 10.01에 용해된 BSA는 Au SPR 칩과 세 가지 조건 중 가장 낮은 반응을 보였다.
하지만 pH 4.01, pH 7.4, 그리고 pH 10.01 용매들의 굴절률이 다르기 때문에 그 반응 값들도 다르게 나타날 수 있으므로, pH 4.01, pH 7.4, 그리고 pH 10.01에 용해된 BSA가 Au SPR 칩과 반응을 한 후 다시 PBS 용액을 주입하여 동일한 용매인 PBS 상에서의 반응 값을 측정하였다. 이를 Table 2에 나열하였다. 또한 비교 용이를 위해 이들 값들 또한 막대 그래프를 이용하여 Fig. 6에 나타내었다. 이 경우도 Table 1과 Fig. 5에서 보는 바와 같이 pH 4.01에 용해된 BSA가 가장 높은 반응을 보였고, 그 다음으로 pH 7.4에 용해된 BSA, 그리고 마지막으로 pH 10.01에 용해된 BSA가 세 조건 중 가장 낮은 반응을 보였다. 하지만이 경우 모든 BSA 반응을 pH 7.4인 PBS 환경 아래에서 측정하여, 다른 pH값을 가진 용매에 용해된 BSA가 그 상태에서 반응한 값들 보다는 작은 값들을 나타내고 있음을 볼 수 있다.

The SPR responses of three identical experiments in PBS after reaction to BSA dissolved in pH 4.01, 7.4, and 10.01.
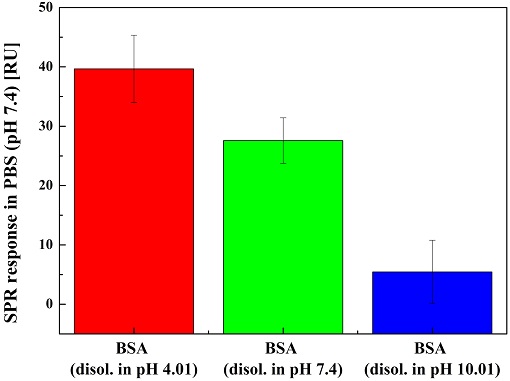
Histogram of the SPR response in PBS after reaction of Au SPR chip to BSA dissolved in pH 4.01, 7.4, and 10.01.
단백질의 표면에서의 반응 활성은 정전기적 반발을 최소화할 수 있는 등전점(pI) 근처에서 가장 크게 일어나는 것으로 보고된다 [14,15]. 앞서 언급한 바와 같이 등전점 이상의 pH에서 단백질은 순(net) 음전하를 띠고, 등점전 이하의 pH에서는 단백질은 순 양전하를 띤다 [16]. BSA의 pI 값이 4.5-5.0으로 pH 4.01에서는 양전하를 띠고, pH 7.4와 10.01에서는 음전하를 띠게 된다. pH 4.01과 pH 7.4에서 용해된 BSA의 보고된 전하량의 크기는 부호는 반대이지만 크기는 유사하거나 pH 4.01에서 조금 작게 보고된다 [17,18]. 본 실험에서의 결과를 보면 BSA의 전하량의 절댓값이 SPR과의 반응에 지배적인 영향을 미치지는 않을 것으로 판단된다. 이 보다는 단백질 표면의 이온성 패치(patch)의 불균일한 분포가 단백질의 순 전하가 양의 전하가 되어도, 패치와 Au 표면 사이에 정전기적 인력을 유발할 수 있다는 것이 보고 [14,15]되어, 위의 실험 결과는 이 원인에 기인한다고 생각할 수 있다.
4. 결 론
BSA를 이용하여 중성이 아닌 양 또는 음전하의 특성을 가지는 단백질이 Au SPR 칩과 반응할 때의 특성을 조사하였다. 일반적으로 BSA의 등전점은 pH 4.5-5.0으로 알려져 있고, 본 실험에 사용된 pH 4.01에서는 양전하를 띠고, pH 7.4와 10.01에서는 음전하를 띠게 된다. 이런 상태에서 Au SPR 칩과의 반응을 살펴보면, pH 4.01에 용해된 BSA가 Au SPR 칩과 가장 높은 반응도를 보였고, 그 다음으로 pH 7.4, 그리고 pH 10.01에 용해된 BSA는 Au SPR 칩과 세 가지 조건 중 가장 낮은 반응을 보였다. 이 반응은 용매의 굴절률이 달라 상대 비교에 적합하지 않기 때문에 BSA가 Au SPR 칩과 반응한 후 세 가지 경우 모두 동일한 환경 조건인 PBS 용액에서 비교 관찰하였다. 이 경우도 pH 4.01에 용해된 BSA가 가장 높은 반응을 보였고, 그 다음으로 pH 7.4에 용해된 BSA, 그리고 마지막으로 pH 10.01에 용해된 BSA가 세 조건 중 가장 낮은 반응을 보였다. 단백질의 표면에서의 반응 활성은 정전기적 반발을 최소화할 수 있는 pI 근처에서 가장 크게 일어나는 것으로 보고된다. 하지만 전하량의 절댓값이 거의 유사한 pH 4.01과 7.4에서 반응이 다르게 나타나는 현상은 단백질 표면의 이온성 패치의 불균일한 분포가 단백질의 순 전하가 표면의 전하와 동일한 유형인 경우에도 패치와 표면 사이에 정전기적 인력을 유발할 수 있기 때문으로 사료된다.
Acknowledgments
본 연구는 2019년 대구가톨릭대학교 연구년 중 수행하였다.
REFERENCES
-
H. Šípová and J. Homola, “Surface plasmon resonance sensing of nucleic acids: A review”, Anal. Chim. Acta, Vol. 773, pp. 9-23, 2013.
[https://doi.org/10.1016/j.aca.2012.12.040]

-
V. Yesudasu, H. S. Pradhan, and R. Jasvanthbhai Pandya, “Recent progress in surface plasmon resonance based sensors: A comprehensive review”, Heliyon, Vol. 7, pp. e06321(1)-e06321(13), 2021.
[https://doi.org/10.1016/j.heliyon.2021.e06321]

-
Q. Wang and Z. Liu, “Recent progress of surface plasmon resonance in the development of coronavirus disease-2019 drug candidates”, Eur. J. Med. Chem. Rep., Vol. 1, pp. 100003(1)-100003(10), 2021.
[https://doi.org/10.1016/j.ejmcr.2021.100003]

-
P. Falkowski, Z. Lukaszewski, and E. Gorodkiewicz, “Potential of surface plasmon resonance biosensors in cancer detection”, J. Pharm. Biomed. Anal., Vol. 194, pp. 113802(1)-113802(11), 2020.
[https://doi.org/10.1016/j.jpba.2020.113802]

-
C. Situ, J. Buijs, M. H. Mooney, and C. T. Elliott, “Advances in surface plasmon resonance biosensor technology towards high-throughput, food-safety analysis”, Trends. Analyt. Chem., Vol. 29, No. 11, pp. 1305-1315, 2010.
[https://doi.org/10.1016/j.trac.2010.09.003]

-
S. B. D. Borah, T. Bora, S. Baruah, and J. Dutta, “Heavy metal ion sensing in water using surface plasmon resonance of metallic nanostructures”, Groundw. Sustain. Dev., Vol. 1, No. 1-2, pp. 1-11, 2015.
[https://doi.org/10.1016/j.gsd.2015.12.004]

- R. D. Knight, Physics for Scientists and Engineers (4th/ed.: Korean language edition), Cheong Moon Gak Publishing Company, Gyeonggi-do, pp. 464-1047, 2019.
- L. Stryer, Biochemistry (4th/ed.), New York, W. H. Freeman and Company, NY, p. 48, 1995.
-
B. E. Givens, N. D. Diklich, J. Fiegel, and V. H. Grassian, “Adsorption of bovine serum albumin on silicon dioxide nanoparticles: Impact of pH on nanoparticle–protein interactions”, Biointerphases, Vol. 12, No. 2, pp. 02D404(1)-02D404(9), 2017.
[https://doi.org/10.1116/1.4982598]

-
H. T. M. Phan, S. Bartelt-Hunt, K. B. Rodenhausen, M. Schubert, and J. C. Bartz, “Investigation of bovine serum albumin (BSA) attachment onto self-assembled monolayers (SAMs) using combinatorial quartz crystal microbalance with dissipation (QCM-D) and spectroscopic ellipsometry (SE)”, PLoS One, Vol. 10, No. 10, pp. e0141282(1)-e0141282(20), 2015.
[https://doi.org/10.1371/journal.pone.0141282]

-
T. Kopac, K. Bozgeyik, and J. Yener, “Effect of pH and temperature on the adsorption of bovine serum albumin onto titanium dioxide”, Colloids Surf. A Physicochem. Eng. Asp., Vol. 322, pp. 19-28, 2008.
[https://doi.org/10.1016/j.colsurfa.2008.02.010]

-
H. Kim, C. D. Kim, and Y. S. Sohn, “Characteristics of a bimetal-layer chip of a surface plasmon resonance sensor in the intensity interrogation for tumor marker detection”, J. Sens. Sci. Technol., Vol. 25, No. 4, pp. 243-246, 2016.
[https://doi.org/10.5369/JSST.2016.25.4.243]

- https://imagej.nih.gov/ij/, (retrieved on Aug. 30, 2021).
-
W. C. Lee, J. S. Ko, and H. M. Kim, “Effect of electrostatic interaction on the adsorption of globular proteins on octacalcium phosphate crystal film”, J. Colloid Interface Sci., Vol. 246, No. 1, pp. 70-77, 2002.
[https://doi.org/10.1006/jcis.2001.8026]

-
M. Alkan, Ö. Demirbaş, M. Doğan, and O. Arslan, “Surface properties of bovine serum albumin – adsorbed oxides: Adsorption, adsorption kinetics and electrokinetic properties”, Microporous Mesoporous Mater., Vol. 96, No. 1-3, pp. 331-340, 2006.
[https://doi.org/10.1016/j.micromeso.2006.07.007]

-
V. Lesins and E. Ruckenstein, “Protein coated adsorbents for use in potential barrier chromatography: Fouling chromatography”, Biotechnol. Prog., Vol. 4, No. 1, pp. 12-24, 1988.
[https://doi.org/10.1002/btpr.5420040104]

-
V. L. Vilker, C. K. Colton, and K. A. Smith, “The osmotic pressure of concentrated protein solutions: Effect of concentration and pH in saline solutions of bovine serum albumin”, J. Colloid Interface Sci., Vol. 79, No. 2, pp. 548-566, 1981.
[https://doi.org/10.1016/0021-9797(81)90106-5]

-
D. Fologea, B. Ledden, D. S. McNabb, and J. Li, “Electrical characterization of protein molecules by a solid-state nanopore”, Appl. Phys. Lett., Vol. 91, pp. 053901(1)-053901(3), 2007.
[https://doi.org/10.1063/1.2767206]