1-propanol 첨가에 따른 이산화타이타늄(TiO2) 광 촉매의 비표면적 향상 및 이산화탄소 환원 효율 향상
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Recently, the problem of global warming caused by greenhouse gases is getting serious due to the development of industry and the increase in transportation means. Accordingly, the need for a technology to reduce carbon dioxide, which accounts for most of the greenhouse gas, is increasing. Among them, a catalyst for converting carbon dioxide into fuel is being actively studied. Catalysts for reducing carbon dioxide are classified into thermal catalysts and photocatalysts. In particular, the photocatalyst has the advantage that carbon dioxide can be reduced only by irradiating ultraviolet rays at room temperature without high temperature or additional gas. TiO2 is widely used as a photocatalyst because it is non-toxic and has high stability, but has a disadvantage of low carbon dioxide reduction efficiency. To increase the reduction efficiency, 1-propanol was used in the synthesis process. This prevents agglomeration of the catalyst and increases the specific surface area and pores of TiO2, thereby increasing the surface area in contact with carbon dioxide. As a result of measuring the CO2 reduction efficiency, it was confirmed that the efficiency of TiO2 with 1-propanol and TiO2 without 1-propanol was 19% and 12.3%, respectively, and the former showed a 1.5 times improved efficiency.
Keywords:
Photocatalyst, Titanium oxide, TiO2, 1-propanol, CO2 reduction, Carbon dioxide1. 서 론
전세계적인 산업 발전 및 자동차, 선박과 같은 운송수단의 증가로, 온실가스에 의해 야기되는 지구온난화 문제가 꾸준히 대두되고 있다. 지구 온난화 문제를 해결하기 위하여, 유럽연합에서는 195개국의 온실 가스 배출량을 제한하여 기온 상승을 억제하는 파리 협정을 채택하였다 [1]. 우리나라는 온실가스 배출량을 2030년까지 37% 감축을 목표로 하였으며, 2050년까지 넷제로(Net—zero), 즉 탄소 배출량 0을 목표하는 정책을 발표하였다. 우리나라는 1990년대 이후 매년 꾸준히 온실가스 배출량이 증가하고 있으며, 그 중 이산화탄소의 배출량은 세계에서 8위에 위치해 있다 [2]. 이산화탄소는 온실가스 중 74.4% 로 지구 온난화의 원인으로서 상당 부분을 차지하고 있는 가스이며, 온실 가스 감축 목표를 달성하기 위해 이산화탄소 배출 관리에 대한 기술의 개발의 필요성이 급증하고 있다. 이산화탄소 배출을 관리하기 위한 기술로 CCS(Carbon capture & storage)기술과 DAC(Direct air capture)기술이 대표적이다 [3]. CCS기술은 공장의 굴뚝과 같은 점 오염원에 설치하여 이산화탄소를 배출원에서 바로 포집 하는 기술이고, DAC 기술은 대기중의 이산화탄소를 포집 하는 기술이다. 두 기술 모두 이산화탄소를 포집하여 탄소 배출량을 감소시킬 수 있지만, 저장된 이산화탄소를 활용가능한 가스로 치환하는 추가적인 화학적 처리과정이 필수적이다. 이에 비해 촉매기술은 대기중의 이산화탄소를 추가적인 과정 없이 메탄화 하여 연료로 활용가능한 가스로 치환가능 하다는 장점이 있다 [4]. 촉매 기술은 크게 열 촉매 기술과 광 촉매 기술로 분류된다[5, 6]. 그 중에서도 광 촉매 기술은, 열 촉매 기술이 고온 및 수소 가스 주입이 필요한 것과 달리, 상온에서 수분 및 자외선만으로 이산화탄소를 메탄으로 치환 가능하다는 장점이 있다 [7], TiO2 나노 입자는 광 촉매로 가장 널리 사용되는 반도체 물질로서, 높은 산화 전위(oxidative potential), 무독성, 화학적, 열적 안정성과 같은 장점들이 있다 [8]. TiO2나노 입자의 결정상 형태는 아나타제 (Anatase), 루타일 (Rutile), 브루카이트 (Brookite)으로 분류된다 [9]. 특히, 전자 전달 능력이 높은 아나타제와 광 활성 에너지가 낮은 루타일이 혼합된 결정상 형태가 가장 효율적인 광 촉매로서 작용하는 것으로 보고되고 있다 [10]. 따라서 본연구에서는, 이러한 장점을 가지는 아나타제-루타일 혼합형 TiO2나노 입자를 합성하여 메탄화를 통한 이산화탄소 환원 기술에 적용하였으며, 기존 TiO2 광 촉매의 낮은 환원 효율을 개선하기 위하여, 합성과정에서 상대적으로 낮은 극성을 가지는 1-propanol을 적용하여 촉매의 표면적을 향상시키고 효율을 개선시키는 연구를 진행하였다 [11].
2. 연구 방법
2.1 TiO2 광 촉매 합성
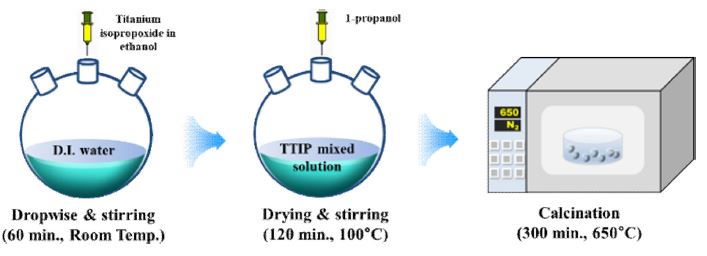
광 촉매에 촉매 보다 높은 에너지를 가지는 빛을 조사하였을 때, 생성된 전자-정공 쌍에 의해 전도대 (conduction band, CB)에서 전자에 의해 이산화탄소가 환원되며, 가전자대 (valence band, VB)에서 정공에 의해서 물이 산화된다. 이때, 촉매의 종류에 따라 이산화탄소의 산화 환원 전위에 의해 치환되는 가스가 변화한다 [12]. 본 연구에서는, 이산화탄소를 메탄으로 치환하기 위한 에너지 준위를 갖춘 TiO2나노 입자를 졸-겔법으로 합성하였다. 6.1 g의 titanium isopropoxide (TTIP)를 20ml의 에탄올에 주입하여 15분 동안 교반 하여 용해하였다. 100 ml의 증류수에 용해된 TTIP 용액을 한 방울씩 (dropwise) 주입하였으며, 60분 동안 상온에서 교반 하였다. 그 후 촉매의 효율 향상을 위해 유기용매인 4 ml의 1-propanol을 주입하고, 100도의 hot plate에서 2시간 동안 교반 하여 졸 형태를 얻는다. 마지막으로 졸의 형태를 100도의 진공 오븐으로 2시간 동안 어닐링 한 후, 질소 분위기의 퍼니스를 통해 650°C (ramp rate = 3 도/분)에서 5시간동안 하소하였다.
합성된 TiO2나노 입자의 결정 형태를 확인하기 위해서 전계방사 주사 현미경 (FE-SEM, Hitachi 4700)을 이용하여 분석을 진행하였다. 결정 구조 분석을 위해 X선 회절분석기(XRD, D/MAX-II)를 이용하여, 20 kV, 100 mA의 조건에서 5~90의 범위로 분석을 진행하였다. 비표면적 및 기공 크기를 분석하기 위하여 Brunauer-Emmett-Teller (BET, Autosorb-IQ)를 이용하였다.
2.2 이산화탄소 환원 측정 및 분석 방법
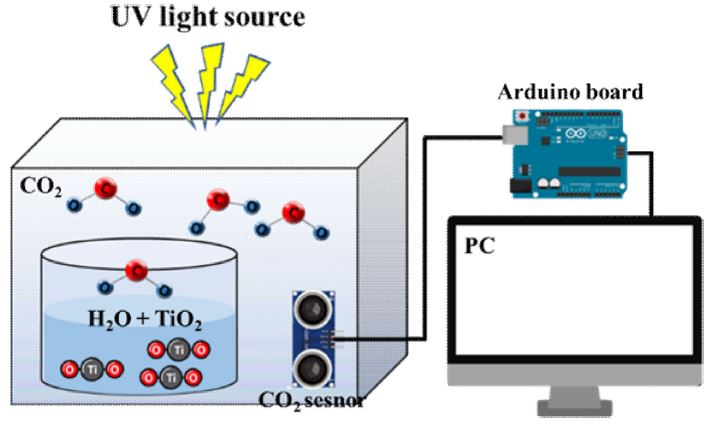
본 연구에서는 Fig. 2와 같이 구성된 측정 시스템을 사용하였다. 진공 챔버 내에 촉매를 위치하기 위한 비커를 설치하고 50 ml의 증류수와 0.5 g의 합성된 TiO2 나노 입자를 10분 동안 교반하여 주입하였다. 이산화탄소 농도를 측정하기 위하여 이산화탄소 센서를 챔버 내부에 설치하였으며, 이 센서는 아두이노 보드를 통해 실시간으로 측정을 가능하게 하였다.
촉매 반응 실험은 다음과 같은 순서로 진행되었다. 촉매 및 센서가 설치된 챔버를 15분 동안 진공 펌프를 작동하여 진공 상태로 만들어 준 후, 대기압이 될 때까지 1000 ppm 농도의 이산화탄소 가스를 주입하였다. TiO2나노 입자와 이산화탄소의 광촉매 반응을 위해 진공 챔버 상단에 12 W의 UV 광원을 설치하여 조사하였으며, UV 램프 외 자연광 및 외부 광원에 의한 변수를 제거하기 위하여 암실 환경을 조성하여 실시간 이산화탄소 농도를 측정하였다. 측정 시간은 촉매 반응이 충분히 진행되어 포화되는 시점인 12000 sec 동안 진행하였다.
3. 결과 및 고찰
3.1 TiO2 광 촉매 특성
합성된 TiO2나노 입자를 확인하기 위하여 FE-SEM 분석을 진행하였다. Fig. 3은 합성된 TiO2 나노 입자 (without 1-propanol, with 1-propanol)의 FE-SEM 이미지를 보여주고 있다. 1-propanol을 첨가한 TiO2 나노 입자들은 구형 형태로 균일하게 분포하고 있으나, 증류수로만 합성한 광 촉매 TiO2나노 입자는 응집된 형태를 이루고 있음이 드러났다. 또한, 광 촉매들의 평균 입자 크기를 측정해본 결과 1-propanol이 첨가되지 않은, 증류수로만 제조한 광 촉매 TiO2나노 입자의 크기는 약 32 nm로 확인되었으며, 1-propanol을 첨가한 TiO2나노 입자는 약 21 nm로 증류수로만 합성한 것 보다 1-propanol을 첨가한 TiO2 나노 입자의 크기가 약 11 nm 더 작음을 확인할 수 있다. 따라서 합성 시1-propanol을 주입함에 따라, 합성하는 동안 입자의 응집 현상을 방지하여 입자의 품질 향상 및 단위면적 당 표면적을 증가시키는 것을 확인하였다.
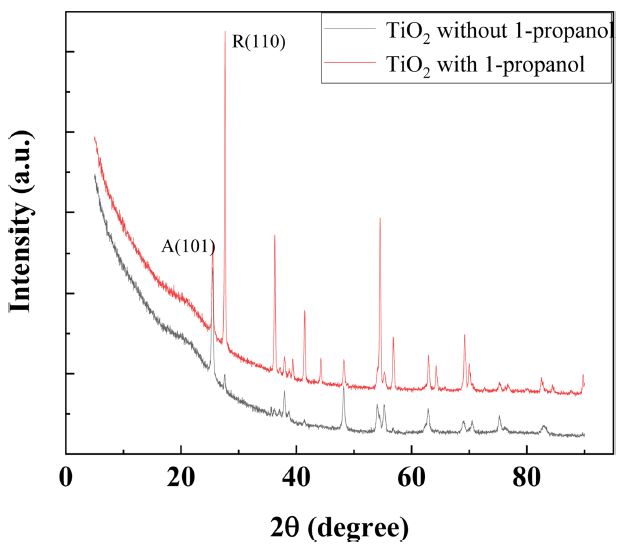
합성된 TiO2나노 입자의 결정 분석을 위해 XRD 분석을 진행하였다. Fig. 4에서 볼 수 있듯이, 합성된 TiO2나노 입자는 회절각이 25.3°, 27.6°에서 강한 피크를 나타내고 있으며, 이는 TiO2나노 입자의 결정상 형태가 아나타제 (A)와 루타일 (R) 결정의 혼합 형태 특성을 가지고 있음을 확인할 수 있다 [13,14]. 특히, 1-propanol이 첨가된 TiO2나노 입자의 루타일 피크 (110)가 더 강한 것으로 보아, 1-propanol이 첨가되지 않은 TiO2 나노 입자보다 루타일 결정 형태의 비율이 더 높은 것을 확인할 수 있다.
또한, 합성된 TiO2나노 입자의 비표면적을 확인하기 위하여 BET 분석을 진행하였고, Barrett-Joyner-Halenda (BJH) 법을 통해 기공크기 및 분포도를 확인하였다 [15]. 그 결과, Table 1에서 확인할 수 있듯이, 1-propanol을 첨가하여 합성된 TiO2나노 입자는 첨가하지 않은 TiO2나노 입자에 비해서 비표면적이 37% 증가하며, 기공은 67% 증가하는 것을 확인할 수 있다.
3.2 이산화탄소 환원 실험
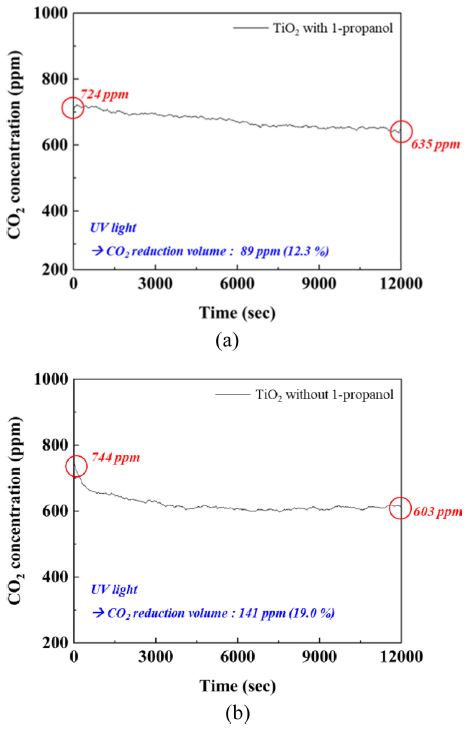
합성을 통해 얻어진 TiO2나노 입자의 이산화탄소 환원 특성을 확인하기 위하여 위의 측정시스템을 이용하여 이산화탄소의 농도를 2초 간격으로 200 분 동안 실시간으로 측정하였다. 이산화탄소 주입 직후 농도의 안정화를 위하여 10분 대기 후 UV 광원을 조사한 뒤 암실을 조성하여 측정을 시작하였다. 측정 결과, Fig. 5에서 확인할 수 있듯이, 1-propanol이 첨가되지 않은 TiO2나노 입자는 초기 이산화탄소 농도 724 ppm에서 89 ppm 감소한 635 ppm으로 약 12.3 %의 이산화탄소 환원율을 확인하였으며. 1-propanol 이 첨가된 TiO2나노 입자는 초기 이산화탄소 농도 744 ppm에서 141 ppm 감소한 603 ppm으로 약 19 %의 이산화탄소 환원율로, 약 1.5 배 증가된 효율을 확인하였다. 이는 합성과정에서 1-propanol 첨가로 인하여 TiO2나노 입자의 비표면적이 37%, 기공이 67% 증가함에 따라 이산화탄소와 접촉하는 면적에 크게 증가하여 향상된 효율을 나타내는 것으로 판단된다.
또한, 기본적인 아나타제 결정 형태의TiO2나노 입자의 광 촉매 반응은 이산화탄소를 메탄으로 치환하는 메커니즘으로 이산화탄소를 환원시키며, 이는 산화 환원 전위에 따라 식 (1), (2)에 의해 치환된다 [16].
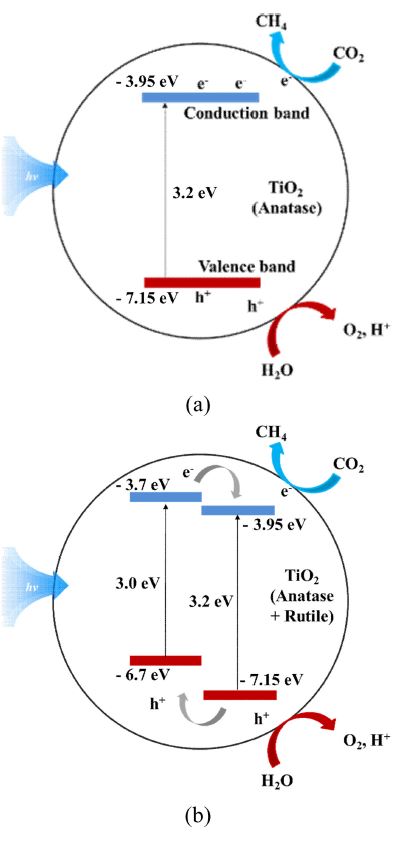
| (1) |
| (2) |
외부 에너지가 가해졌을 때, TiO2나노 입자의 전도대에서는 환원 반응으로 인하여 이산화탄소가 메탄으로 치환되며, 가전자대에서는 산화 반응으로 인하여 물이 O2 와 H+ 로 치환된다. 아나타제 결정은 루타일 결정에 비하여 전자 전달능력이 높아 광촉매 반응이 높다고 보고되고 있으나, 루타일 결정에 비해 큰 밴드갭으로 인하여 큰 에너지를 필요로 한다. 루타일 결정은 상대적으로 전자 전달능력이 낮으나 작은 밴드갭으로 인하여 작은 에너지로도 광 촉매 반응이 가능하다. 본 연구에서 합성된 TiO2나노 입자는 아나타제와 루타일 결정의 혼합 형태이다. 따라서, 작은 밴드갭을 가지고 있는 루타일 결정이 작은 에너지로 활성화되어 아나타제 결정으로 전자를 전달할 수 있으며, 전자를 전달받은 아나타제 결정은 작은 에너지에서도 높은 광 촉매 반응을 가능하게 한다 [17,18]. XRD 분석 결과에서 확인하였듯이, 1-propanol이 첨가된 TiO2나노 입자에서 루타일 결정 피크가 더 강하게 나타나는 것을 확인하였다. 따라서, TiO2 나노 입자 합성과정에서 첨가된 1-propanol은, TiO2나노 입자의 표면적 및 기공을 증가시켜 효율을 향상시킬 뿐만 아니라, TiO2나노 입자의 아나타제/루타일 결정의 비율 또한 최적화하여 더 높은 효율을 나타내는 것으로 판단된다.
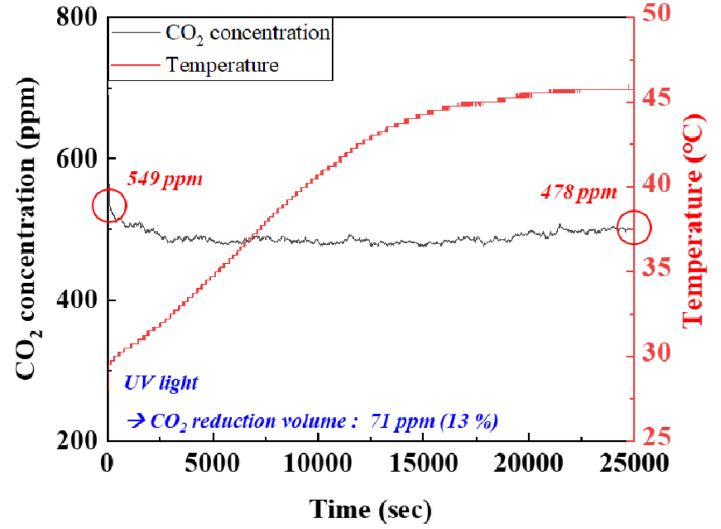
온도에 따른 TiO2 나노 입자의 광 촉매 반응을 확인하기 위하여 챔버 내부의 온도를 28에서 47°C까지 증가시키며 이산화탄소의 농도를 측정하였다. 측정 결과, Fig. 7에서 확인할 수 있듯이, 이산화탄소 농도 환원율은 13%로 상온에서의 환원율(19%)보다 현저히 낮은 효율을 나타내는 것을 확인하였다. 이는, 이산화탄소는 온도가 증가함에 따라 용매에 대한 용해도가 감소하여, 광 촉매와 반응하기 위한 용매내 이산화탄소의 농도가 감소하므로 환원 효율이 감소하는 것으로 판단된다. 또한, 온도가 약 45°C에 도달하였을 때, 이산화탄소의 농도가 증가하는 것을 확인할 수 있었으며, 이는 용매내의 이산화탄소가 외부로 배출되며 챔버 내부의 이산화탄소 농도를 증가시킨 것으로 판단된다. 따라서 TiO2 나노 입자의 광 촉매 반응은 상온에서 가장 높은 효율을 나타내는 것으로 판단된다.
4. 결 론
본 연구에서 이산화탄소 저감 기술을 위한 광촉매로 TiO2나노 입자를 졸-겔법으로 합성하였으며, TiO2나노 입자의 효율 향상을 위해 유기 용매인 1-propanol을 합성과정에 적용하여 합성하였다. 합성된 TiO2나노 입자의 특성을 확인하기 위하여, FE-SEM, XRD, BET 분석을 진행하였다. 분석 결과, FE-SEM 이미지를 통해 1-propanol이 적용된 TiO2나노 입자는 평균 21 nm의 입자크기를 나타내는 것을 확인하였으며, 입자간 낮은 응집력으로 인하여 고르게 분포하는 것을 확인하였다. 또한 XRD 분석을 통해, 합성된 TiO2 나노 입자 모두 25.3°, 27.6°에서 피크를 나타내는 아나타제-루타일 결정 혼합 형태의 특성을 가진 것을 확인하였으며, 1-propanol이 첨가된 TiO2나노 입자의 루타일 비율이 더 높은 것을 확인하였다. 또한, BET 분석을 통해 1-propanol이 적용된 TiO2나노 입자는 비표면적과 기공이 각각 약 37%, 67% 증가된 것을 확인하였다. 합성된 TiO2나노 입자의 이산화탄소 환원 효율은 준비된 측정 시스템을 이용하여 측정되었다. 1-propanol이 적용된 TiO2나노 입자는 19%의 환원 효율을 보여주었으며, 1-propanol이 적용된 TiO2 나노 입자 대비 약 1.5 배 효율이 향상된 것을 확인하였다. 이는 1-propanol 첨가로 인하여 증가된 비표면적 및 기공으로 인하여, TiO2나노 입자가 이산화탄소와 접촉하는 표면적이 향상되어 효율이 증가한 것으로 판단된다. 또한, 1-propanol이 첨가된 TiO2나노 입자의 루타일 비율이 더 높은 것으로 보아, 이산화탄소 환원에 있어, 1-propanol이 첨가된 TiO2나노 입자가 더 최적화된 아나타제-루타일 비율을 가져 이산화탄소 환원 효율이 향상된 것을 확인하였다. 본 연구에서 개발된 이산화탄소 환원 기술은 물, TiO2 나노입자, UV 광원으로 환원 가능한 기술로써, 추후 태양광을 이용하여 대기중의 이산화탄소를 인위적인 에너지 소비 없이 환원할 수 있는 기술로 확장 가능할 것으로 예상한다.
Acknowledgments
이 논문은 2020년도 정부(과학기술정보통신부)의 재원으로 연구개발특구진흥재단의 지원을 받아 수행된 연구임(2020-DD-UP-0348). 본 논문은 한국생산기술연구원 기본사업 "산업재해 및 안전사고 방지를 위한 변색성 유해가스 감지 실용화 센서 시스템 개발 (Kitech UI-22-0016)"지원으로 수행한 연구임. 본 연구는 2021년도 중소벤처기업부의 기술개발사업 지원에 의한 연구임 [S3177927].
References
-
C. Horowitz, “Paris Agreement”, Int. Leg. Mater., Vol. 55, No. 4, pp. 740-755, 2016.
[https://doi.org/10.1017/S0020782900004253]

- https://worldpopulationreview.com/country-rankings/co2-emissions-by-country, (retrieved on Aug. 23, 2022)
-
A. I. Osman, M. Hefny, M. I. A. A. Maksoud, A. M. Elgarahy, and D. W. Rooney, “Recent advances in carbon capture storage and utilisation technologies: a review”, Environ. Chem. Lett., Vol. 19, No. 1, pp. 797-849, 2021.
[https://doi.org/10.1007/s10311-020-01133-3]

-
D. Jiang, Y. Zhou, Q. Zhang, Q. Song, C. Zhou, X. Shi, and D. Li, “Synergistic Integration of AuCu Co-Catalyst with Oxygen Vacancies on TiO2 for Efficient Photocatalytic Conversion of CO2 to CH4”, ACS Appl. Mater. Interfaces, Vol. 13, No. 39, pp. 46772-46782, 2021.
[https://doi.org/10.1021/acsami.1c14371]

-
J. Hu, L. Buelens, S. A. Theofanidis, and V. V. Galvita, “CO2 conversion to CO by auto-thermal catalyst-assisted chemical looping”, J. CO2 Util., Vol. 16, No. 1, pp. 8-16, 2016.
[https://doi.org/10.1016/j.jcou.2016.05.006]

-
A. Razzaq, and S.I. In, “TiO2 based nanostructures for photocatalytic CO2 conversion to valuable chemicals”, Micromachines, Vol. 10, No. 5, pp. 326-350, 2019.
[https://doi.org/10.3390/mi10050326]

-
H. Park, H. H. Ou, U. Kang, J. Choi, and M. R. Hoffmann, “Photocatalytic conversion of carbon dioxide to methane on TiO2/CdS in aqueous isopropanol solution”, Catal. Today, Vol. 266, No. 1, pp. 153-159, 2016.
[https://doi.org/10.1016/j.cattod.2015.09.017]

-
T. Ochiai, and A. Fujishima, “Photoelectrochemical properties of TiO2 photocatalyst and its applications for environmental purification”, J. Photochem. Photobiol. C, Vol. 13, No. 4, pp. 247-262, 2012.
[https://doi.org/10.1016/j.jphotochemrev.2012.07.001]

-
J. Zhang, P. Zhou, J. Liu, and J. Yu, “New understanding of the difference of photocatalytic activity among anatase, rutile and brookite TiO2”, Phys. Chem. Chem. Phys., Vol. 16, pp. 20382-20386, 2014.
[https://doi.org/10.1039/C4CP02201G]

-
H. Choi, S. Khan, J. Choi, D. Dinh, S. Y. Lee, U. Paik, S. H. Cho, and S. Kim, “Synergetic control of band gap and structural transformation for optimizing TiO2 photocatalysts”, Appl. Catal. B., Vol. 210, No. 5, pp. 513-521, 2017.
[https://doi.org/10.1016/j.apcatb.2017.04.020]

-
O. Wiranwetchayan, S. Promnopas, T. Thongem, A. Chaipanich, and S. Thongtem, “Effect of alcohol solvents on TiO2 films prepared by sol–gel method”, Surf., Vol. 326, No. A, pp. 310-315, 2017.
[https://doi.org/10.1016/j.surfcoat.2017.07.068]

-
S. N. habisreutinger, L. S. Mende, and J. K. Stolarczyk, “Photocatalytic Reduction of CO2 on TiO2 and Other Semiconductors”, Angew. Chem. Int. Ed., Vol. 52, No. 29, pp. 7372-7408, 2013.
[https://doi.org/10.1002/anie.201207199]

-
J. Wang, J. Yu, X. Zhu, and X. Z. Kong, “Preparation of hollow TiO2 nanoparticles through TiO2 deposition on polystyrene latex particles and characterizations of their structure and photocatalytic activity”, Nanoscale Res. Lett., Vol. 7, No. 1, pp. 646-653, 2012.
[https://doi.org/10.1186/1556-276X-7-646]

-
J. He, Y. Du, Y. Bai, J. An, X. Cai, Y. Chen, P. Wang, X. Yang, and Q. Feng, “Facile Formation of Anatase/Rutile TiO2 Nanocomposites with Enhanced Photocatalytic Activity”, Molecules, Vol. 24, No. 16, pp. 2996-3009, 2019.
[https://doi.org/10.3390/molecules24162996]

-
R. Bardestani, G. S. Patience, and S. Kaliaguine, “Experimental methods in chemical engineering: specific surface area and pore size distribution measurements—BET, BJH, and DFT”, Can. J. Chem. Eng., Vol. 97, No. 11, pp. 2781-2791, 2012
[https://doi.org/10.1002/cjce.23632]

-
Y. Mi, and Y. Weng, “Band Alignment and Controllable Electron Migration between Rutile and Anatase TiO2”, Sci. Rep., Vol. 5, No. 1, pp. 11482-11491, 2015.
[https://doi.org/10.1038/srep11482]

-
D. O. Scanlon, C. W. Dunnill, J. Buckeridge, S. A. Shevlin, A. J. Logsdail, S. M. Woodley, C. R. A. Catlow, M. J. Powell, R. G. Palgrave, I. P. Parkin, G. W. Watson, T. W. Keal, P. Sherwood, A. Walsh, and A. A. Sokol, “Band alignment of rutile and anatase TiO2”, Nat. Mater. Vol. 12, No. 1, pp. 798-801, 2013.
[https://doi.org/10.1038/nmat3697]

-
W. Zhang, Y. Hu, L. Ma, G. Zhu, Y. Wang, X. Xue, R. Chen, S. Yang, and Z. Jin, “Progress and Perspective of Electrocatalytic CO2 Reduction for Renewable Carbonaceous Fuels and Chemicals”, Adv. Sci., Vol. 5, No. 1, pp. 1700275-1700298, 2017.
[https://doi.org/10.1002/advs.201700275]