Pt/CNT 전극 기반 전기화학식 센서의 전해질에 따른 황화수소 감지 특성
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
With the recent development of industrial technology, the problem of odor due to leakage of toxic gas discharged from industrial complexes is gradually increasing. Among them, hydrogen sulfide is a colorless representative odorous substance that can cause pain through irritation of the mucous membranes of the eyes and respiratory tract, and is a gas that can cause central nervous system paralysis and suffocation when exposed to high concentrations. Therefore, in order to improve the odor problem, research on a gas sensor capable of quickly and reliably detecting a leak of hydrogen sulfide is being actively conducted. A lot of research has been done on the existing metal oxide-based hydrogen sulfide gas sensor, but it has the disadvantage of requiring low selectivity and high temperature operating conditions. Therefore, in this study, a Pt/CNT-based electrochemical hydrogen sulfide gas sensor capable of detecting at low temperatures with high selectivity for hydrogen sulfide was developed. A working electrode capable of selectively detecting only hydrogen sulfide was fabricated by synthesizing Pt nanoparticles as a catalyst on functionalized CNT and applied to an electrochemical hydrogen sulfide gas sensor. It was confirmed that the manufactured Pt/CNT-based electrochemical hydrogen sulfide gas sensor has a current change of up to 100uA for hydrogen sulfide, and the both response time and recovery time were within 15 seconds.
Keywords:
CNT, Electrochemical gas sensor, Working electrode, Hydrogen sulfide1. 서 론
최근 산업 기술의 발달에 따라 산업 현장에서 발생하는 유해가스로 인한 문제가 대두되고있다. 그 중에서도, 황화수소(H2S)는 산업 현장에서 빈번히 배출되는 가스로, 가연성이 높으며 인체에 500~1000 ppm 의 농도로 노출될 시, 호흡 마비나 질식으로 인하여 의식 불명이나 심하면 사망에 이를 수 있다. 대한직업환경의학회에 따르면, 10 ppm 이하의 저농도에서도 두통, 오심, 수면장애, 인후 및 눈의 자극 등이 나타날 수 있다고 전해진다[1].
또한 황화수소는 10 ppm의 저농도의 누출에도 악취를 유발하여, 불쾌감을 야기할수 있으며 지역사회에서 이로 인한 민원이 발생하고 있다[2]. 따라서, 산업 현장 및 지역사회에서 황화수소를 실시간으로 관리하기 위한 가스 센서에 대한 연구가 활발히 이루어지고 있다. 현재 가장 많이 보고되어 오고 있는 황화수소 가스 센서는, 금속 산화물 기반의 전기저항식 가스 센서로, 비용이 낮고 높은 반응성을 나타내는 반면, 가스에 대한 선택성이 낮아 황화수소 가스만을 감지하는데 어려움이 존재한다[3]. 그에 비해 전기화학식 가스 센서는, 작용 전극과 전해질에 따라 황화수소 가스만을 선택적으로 높은 감도로 감지할 수 있다는 장점을 가진다[4]. 그러나, CNT와 같은 탄소 계열의 작용전극 형성 시, 전처리와 표면처리에 따라 전극의 균일도가 낮으며 신뢰성이 저하된다. 백금으로 단일 전극을 형성 할 시, 부식에 매우 강하고, 안정적인 전기적 특성을 갖지만, 비교적 높은 제작 비용으로 인해 경제성이 떨어진다[5]. 따라서, 본 연구에서는 CNT에 백금을 촉매로서 복합체를 형성하고, 펠트로 제작하여 센서를 제작하여 낮은 비용의 전극으로 안정적인 황화수소 감지가 가능한 센서를 개발하였다. 이렇게 제작된 Pt/CNT전극은 표면의 활성 금속 원자의 증가로 인하여 면적이 탄소나노튜브 기반 펠트에 미세하게 분포된 백금 입자들의 균일한 분포로 촉매의 비표면적을 증가시키고, 특정가스(황화수소)를 선택적으로 감지할 수 있는 장점을 갖는다[6]. 또한, NaOH, KCl, H2SO4를 사용하여 전해질에 따른 황화수소 감지 특성을 측정하였으며, Pt/CNT 전극 기반의 전기화학식 황화수소 가스 센서에서 높은 안정성 및 감도를 가질수 있는 최적의 전해질과 전극의 조건에 대해 연구를 진행하였다[7].
2. 연구 방법
2.1 작용 전극 제작 및 전해질 선정
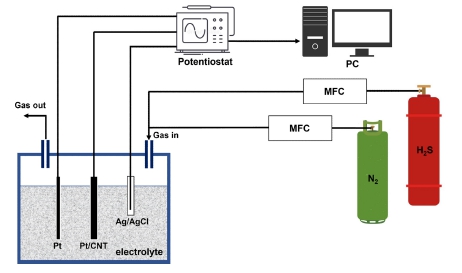
먼저 200mg의 MWCNT를 증류수에 세척 후, 질산에서 6시간동안 환류시켜 산화적으로 활성화시켰다. 산화된 MWCNT는 진공 여과 후, 증류수에 세척하여 질산 및 불순물을 제거 하였으며, 상온에서 12시간 건조시켰다. 그 후, 활성화된 MWCNT 200 mg을 교반기(sonicator)를 사용하여 400 mL 에탄올과 20 mg SDS와 함께 초음파 교반 후, Pt NPs 형성을 위하여 200 mM의 H2PtCl6 용액을 첨가하여 1시간 동안 반응하여 Pt/CNT 용액을 제작하였다. 제작된 Pt/CNT 용액을 다공성의 PTFE 멤브레인에 진공 여과 후, 증류수로 세척하여 불순물을 제거하고 박막을 형성하였으며, 최종적으로 형성된 박막을 유리 기판위에 Ag paste를 이용하여 고정 및 작용전극 형성을 완료하였다. 전해질은 총 세 가지 종류의 전해질 용액이 사용되었으며, 강산성의 H2SO4, 중성의 KCl, 강염기성의 NaOH 용액을 각각 사용하여 감지 특성을 확인하였다.
2.2 순환전압전류법 측정 및 황화수소 감지 특성 평가
순환전압전류법 측정은 potentiostat/galvanostat (ZIVE SP1, ZIVELAB) 장비를 사용하여 측정을 진행하였고, 측정은 상온에서 3전극 구성을 통해 측정하였다. 기준전극은 은-염화은(Ag/AgCl, 3M KCl 포화), 상대전극은 코일형태의 백금을 사용하였으며, 작업전극은 제작된 Pt/CNT기반의 작용전극을 사용하였다[8]. 가스 감지를 위한 기본 순환전압 전류 곡선 특성 측정을 위해, NaOH, KCl, H2SO4 각각 1 M의 전해질 농도 조건에서, 100 mVs-1 의 스캔 속도로 -1.5 ~ 2.0 V 전위 범위를 스윕(sweep)하며 측정하였다. 1M에서 각 전해질 모두 전극 간의 이온 전달이 활발함을 확인하였다[9]. 황화수소 감지 특성 평가는 MFC와 potentiostat 장비를 통해 진행되었으며, 챔버는 위의 CV측정과 동일하게 3개의 전해질을 각각 최적화된 농도로 진행하였으며, 기준전극과 상대전극 또한 동일하게 진행하였다. 가스의 총 유속은 500 sccm이였으며, 310 uV의 분극 전위에서 전류값 차이를 측정하였다.
3. 결과 및 고찰
3.1 순환전압전류법 측정
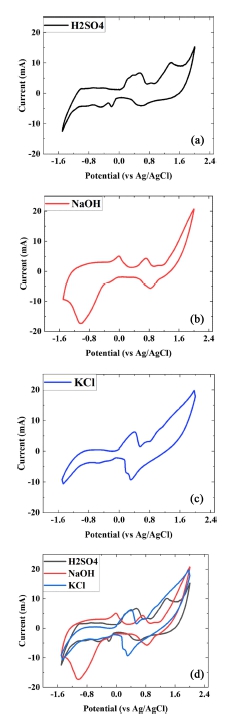
본 실험에서는 각각 KCl, NaOH, H2SO4 의 전해액의 3전극구성의 순환 전압 전류곡선을 측정하였다. 측정은 -1.5 V ~ 2.0 V의 전위 범위에서 100 mVs-1의 스캔 속도로 진행하였고 Fig. 2.와 같이 각 전해질에 따라 순환 전압전류 곡선이 나타나는 것을 알 수 있다. Fig. 2(a)와 (b)에서 보다시피, H2SO4같은 경우, 200~300 mV 부근에서 피크값을 가지며, NaOH 를 전해액으로 사용했을 경우에는, -50 mV와 800 mV에서 두 개의 피크값을 가지는 것을 볼 수 있다. Fig. 2(c)와 같이 KCl에서는 500 mV부근에서 피크값을 가지는 것을 알 수 있고, 이는 500 mV부근에서 높은 산화 활성도를 보임을 알 수 있다. 전해질에 따라 순환 전압 전류특성이 다르게 나타나는 이유는 각각의 전해질의 pH 값이 다르기 때문에 나타나는 현상인데, H2SO4(pH=1)에서 KCl(pH=7), NaOH(pH=12)로 전해질의 pH값이 증가함에 따라 피크가 나타나는 전위값이 음의 값으로 이동했고, 반대로 pH 값이 감소하면 반대 경향이 나타남을 알 수 있다. 그리고 H2SO4가 가장 양의 값으로 peak값을 나타내다 보니, 상대적으로 우측으로 피크값이 이동하여 측정되는 전위 범위 내에서 산화 peak가 1개만 나타났음을 확인할 수 있다.
3.2 황화수소 감지 특성 평가
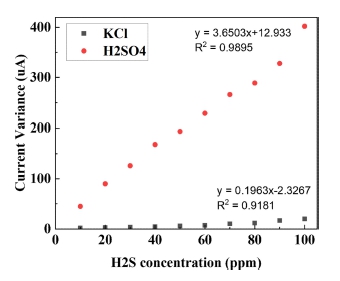
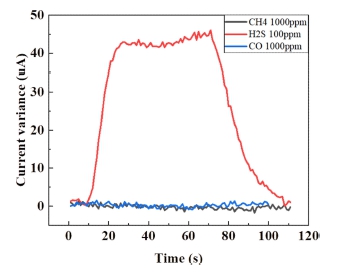
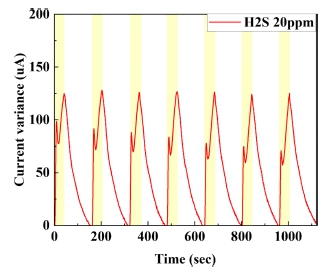
본 실험에서는 제작된 Pt/CNT 작용 전극의 황화수소 감지 특성을 확인하기 위해 기존의 전기화학식 챔버 내부에 황화수소와 질소를 번갈아가며 500 sccm씩 노출시키며 실험을 진행하였다[10]. 반응성과 농도별 선형성을 같이 확인하기 위해 각 전해질마다 10~100 ppm씩 10 ppm 단위로 황화수소를 노출시켰고, balance gas는 질소를 사용하였다. Fig. 3에서 보는것과 같이, KCl과 H2SO4 를 전해질로 사용하였을 때 H2S의 농도에 따라 선형적으로 15초 이내의 반응시간으로 감지함을 확인할 수 있었으며, NaOH 전해질의 경우 감지 특성이 나타나지 않음을 확인할 수 있었다. 이는 보고되고 있는 전기화학식 가스센서의 반응시간이 20초 내외인 것과 비교하였을 때 상대적으로 빠른 반응속도를 가지는 것을 확인할 수 있다[11]. KCl과 H2SO4를 전해질로 사용했을 때, Fig. 4에서 확인할 수 있듯이, 농도에 따른 전류 변화량에 대한 R2값은 각각 0.9181, 0.9895로 선형성을 나타냄을 알 수 있었고[12], H2SO4에서의 반응성이 KCl보다 훨씬 높음을 확인할 수 있다. H2SO4를 전해질로 사용하였을 경우, H2SO4 자체가 전극 표면과 상호작용하여 반응하여 화학적으로 산화되어, H2S가 유입되어 전극에 흡착될 시, H2SO4와 상호작용하여 전기 화학 반응을 일으키고 전류를 생성하게 된다. KCl을 전해질로 사용할 경우, 가스가 전극에 흡착되면 가스 분자의 산화 작용으로 인하여 일어나는 전극 표면의 전하 밀도 변화가 측정되고, 이를 통해 황화수소의 농도를 측정할 수 있다. 그러나, 중성의 KCl 전해질은 전해질로서 안정적인 특성을 지니는 반면, 산화성이 강한 H2SO4와 달리 H2S와 반응하였을 때 상대적으로 낮은 전기 화학 반응으로 인하여, 낮은 감도를 가지게된다[13]. 제작된 Pt/CNT 감지전극 기반의 전기화학식 가스 센서의 선택성을 확인하기 위하여, 같은 산화종으로 황화수소 감지 시 간섭특성을 나타낼 수 있는, CH4(1000 ppm)와 CO(1000 ppm)에 대한 응답도를 확인하였다[14]. 그 결과, Fig. 5에서 확인할 수 있듯이, H2S 100 ppm에 대비하여 CO나 CH4와는 상대적으로 거의 반응성이 나타나지 않음을 알 수 있었으며, 제작된 Pt/CNT 감지전극은 황화수소를 선택적으로 감지할 수 있는 것을 확인할 수 있었다. 또한, 제작된 Pt/CNT 감지전극의 신뢰성을 확인하기 위하여 H2SO4를 전해질로 사용하여 황화수소 20 ppm에 반복적으로 노출시키는 실험을 진행하였으며, Fig. 6에서 보는것과 같이 일정한 전류값이 반복적으로 나타나는 것을 확인하였다.
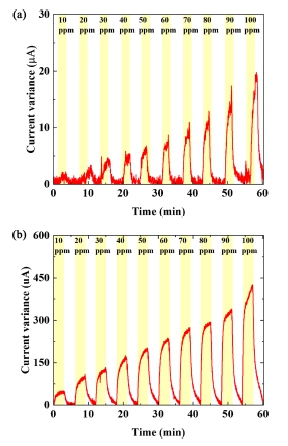
Sensing response of Pt/CNT sensors to concentration from 10 to 100 ppm (a) with KCl, (b) with H2SO4.
4. 결 론
본 연구에서는 Pt/CNT 작용 전극을 제작하고, 이를 이용하여 황화 수소를 감지하기 위한 액체 전기화학식 센서를 제작하였다. Pt/CNT 작용 전극을 제작하기 위해 CNT 용액에 백금 전구체 물질을 첨가하여 용액을 제조 후 소수성의 다공성 막인 PTFE에 진공 여과하여 필름을 제작하였다. 그 후, 상대전극과 작업 전극 물질 선정 후, 강산, 중성, 강염기 물질인 H2SO4, KCl, NaOH를 전해질로 각각 사용하여 순환 전압전류 그래프를 분석하였다. 순환 전압전류 그래프 분석을 통해, 전해질에 따른 전류 특성은 pH값이 증가할수록 전위값이 음의 방향으로 이동되는 현상을 확인할 수 있었으며, 황화 수소 측정을 위한 분극 전위는 310 uV로 설정되었다. 10~100 ppm 농도의 황화수소 측정 결과, 제작된 Pt/CNT 작용 전극 기반의 전기화학식 황화수소 가스는, H2SO4와 KCl 전해질에서 각각 450, 20 uA 의 전류 변화를 나타내는 것을 확인하였으며, H2SO4 전해질은 KCl 대비 최대 15배 이상의 반응성으로 높은 것을 확인할 수 있었다. 또한, H2SO4 전해질 조건에서, 같은 산화성 가스와 반응성을 비교하였을때, 황화수소에 선택적으로 반응하는 것을 확인하였으며, 이는 제작된 Pt/CNT 기반의 전기화학식 가스센서는 H2SO4 전해질에서 높은 감도로 황화수소만을 선택적으로 감지할 수 있는 것을 확인하였다.
Acknowledgments
이 논문은 2020년도 정부(과학기술정보통신부)의 재원으로 연구개발특구진흥재단의 지원을 받아 수행된 연구임(2020-DD-UP-0348).
본 연구는 대한민국 정부(산업통상자원부 및 방위사업청) 재원으로 민군협력진흥원에서 수행하는 민군기술협력사업의 연구비 지원으로 수행되었습니다.(과제번호 21-SF-BR-05)
본 논문은 한국생산기술연구원 기관주요사업 “다중채널(Multi-channel) 기반의 광학필터를 적용한 온실 가스(CO, CO2) 감지용 비분산적외선(Non-Dispersive Infrared) 센서 개발 (Kitech JD-23-0006)”의 지원으로 수행한 연구입니다.
REFERENCES
- I. H. Jung, “A case of hydrogen sulfide poisoning caused by unauthorized discharge of wastewater”, J. Korean Soc. Occup. Environ. Med., pp. 135-135, 2022.
-
H. S. Gu, Z. Wang, and Y. M. Hu, “Hydrogen gas sensors based on semiconductor oxide nanostructures”, Sens., Vol. 12, No. 5, pp. 5517-5550, 2012.
[https://doi.org/10.3390/s120505517]

-
Y. F. Luo, C. Zhang, B. Zheng, X. Geng, and M. Debliquy, “Hydrogen sensors based on noble metal doped metal-oxide semiconductor: A review”, Inter. J. Hydrogen Energy, Vol. 42, No. 31, pp. 20386-20397, 2017.
[https://doi.org/10.1016/j.ijhydene.2017.06.066]

-
A. F. IM, F. Awwad, Y. E. Greish, and S. T. Mahmoud, “Hydrogen sulfide (H 2 S) gas sensor: A review”, IEEE Sens. J., Vol. 19, No. 7 , pp. 2394-2407, 2018.
[https://doi.org/10.1109/JSEN.2018.2886131]

-
X. Y. Yang, Y. Zhang, X. Hao, Y. Song, X. Liang, and F. Liu, “Nafion-based amperometric H2S sensor using Pt-Rh/C sensing electrode”, Sens. Actuators B: Chem., Vol. 273, pp, 635-641, 2018.
[https://doi.org/10.1016/j.snb.2018.06.087]

-
D. D. La, C. K. Kim, T. S. Jun, Y. Jung, G. H . Seong, J, Choo. and Y. S. Kim, “Pt nanoparticle-supported multiwall carbon nanotube electrodes for amperometric hydrogen detection”, Sens. Actuators B: Chem., Vol. 155, No. 1, pp. 191-198, 2011.
[https://doi.org/10.1016/j.snb.2010.11.045]

-
J. Gębicki, A. Kloskowski, W. Chrzanowski, P. Stepnowski, and J. Namiesnik, “Application of ionic liquids in amperometric gas sensors”, Crit. Rev. Anal. Chem., Vol. 46, No. 2, pp. 122-138, 2016.
[https://doi.org/10.1080/10408347.2014.989957]

-
G. Schiavon, G. Zotti, R. Toniolo, and G. Bontempelli, “Electrochemical detection of trace hydrogen sulfide in gaseous samples by porous silver electrodes supported on ion-exchange membranes (solid polymer electrolytes)”, Anal. Chem., Vol. 67, No. 2, pp. 318-323, 1995.
[https://doi.org/10.1021/ac00098a015]

-
R. Baron and J. Saffell, “Amperometric gas sensors as a low cost emerging technology platform for air quality monitoring applications: A review”, ACS Sens.,Vol. 2, No. 11, pp. 1553-1566, 2017.
[https://doi.org/10.1021/acssensors.7b00620]

-
P. Zuo, R. Wang, F. Li, F. Wu, G. Xu, and W. Niu, “A trace ppb-level electrochemical H2S sensor based on ultrathin Pt nanotubes”, Talanta 233, p. 122539. 2021.
[https://doi.org/10.1016/j.talanta.2021.122539]

-
J. Li, Y. Wang, X. Gao, Q. Ma, L. Wang, and J. Han, “H2S sensing properties of the SnO2-based thin films”, Sens. Actuators B, Vol. 65, pp. 111–113, 2000.
[https://doi.org/10.1016/S0925-4005(99)00406-2]

-
A. M. Nima, C. Zuidema, S. Sousan, L. Hallett, M. Tatum, A. M. Rule, G. Thomas, T. M. Peters, and K. Koehler, “Evaluation of low-cost electro-chemical sensors for environmental monitoring of ozone, nitrogen dioxide, and carbon monoxide”, J. Occup. Environ. Hyg., Vol. 15, No. 2, pp. 87-98, 2018.
[https://doi.org/10.1080/15459624.2017.1388918]

-
J. Gębicki, A. Kloskowski, W. Chrzanowski, P. Stepnowski, and J. Namiesnik, “Application of ionic liquids in amperometric gas sensors”, Crit. Rev. in Anal. Chem., Vol. 46, No. 2, pp. 122-138, 2016.
[https://doi.org/10.1080/10408347.2014.989957]

-
C. B. Yu, Y. Wang, K. Hua, W. Xing, and T. Lu, “Electrochemical H2S sensor with H2SO4 pre-treated Nafion membrane as solid polymer electrolyte”, Sens. Actuators B: Chem., Vol. 86, No. 2-3, pp. 259-265, 2002.
[https://doi.org/10.1016/S0925-4005(02)00200-9]