전계효과트랜지스터(FET) 바이오센서 실험 셋업 분석을 통한 동작원리 이해
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License(https://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Over the past few decades, considerable research has been conducted on field-effect transistor (FET) biosensors; however, other than electrochemical sensors for pH, they have not reached the commercialization stage and still remain at the basic research level. Although several reports have been published on experiments with real biological samples, no reports exist of developments that have reached commercialization or finalized approval for use. In this paper, we explain the reason for the experiments of FET biosensors to induce spurious signals in an experimental setup and explain the existence of misunderstandings regarding the operating principle of FET biosensors owing to the spurious signals. Based on the thoughtful review of the results of previously published papers, we show that the electrochemical read-out principle of FET biosensors requires our intensive understanding of the interfacial potential between the solution and the sensor electrode for further progress in the FET biosensor research.
Keywords:
Field-effect transistor(FET) biosensor, Electrochemical sensing, Electrochemical sensor read-out, Fake response1. 서 론
지난 수십년 전부터 전계효과트랜지스터(FET)를 바이오센서로 응용하는 연구가 많이 있었다[1-28]. 용액의 pH농도와 이온 농도에 대한 센싱 이외에도 전하를 띤 바이오분자 자체를 검출할 수 있다는 기대로 반도체 나노와이어나 CNT 혹은 그래핀 등 반도체 나노소자 FET를 바이오센서로 활용해보려는 노력이 이어졌다[1-16,20,24,25]. 하지만 FET 바이오센서 실험 셋업에서 센서신호 측정분석에 대한 이해가 부족하여 가짜 신호를 검출 반응으로 해석하는 사례가 있고[2-9], 이로 인해 바이오센서 실험 결과의 해석에서 실험 셋업에 대한 이해가 필요함을 보여주는 연구도 진행되었다[15,17,18]. 여기서는 나노소재 FET를 바이오센서나 pH센서로 응용할 때 센싱 동작원리에 대한 이해가 명확하지 않아 쉽게 간과해 왔던 실험 셋업에서의 오류를 설명하고 잘못된 실험 셋업에 의해 가짜 FET 반응 신호가 나타날 수 있는 이유를 제시한다. 전기화학센서 읽기(read-out) 회로와의 비교 설명을 통해 FET 바이오센서의 원리를 좀 더 쉽게 파악할 수 있도록 하고, FET 바이오센서 실험에서 신호 측정 시 확인이 필요한 가짜 신호 발생 이유와 가짜신호라고 해석할 수 있는 근거를 설명한다. FET 바이오센서 연구들이 제시해 온 실험결과들에서 논의가 필요한 사항과 그 특징을 센서의 동작 메커니즘 관점에서 검토하고 분석한다.
2. 전위 측정 회로의 이해
2.1 전기화학센서 읽기 회로
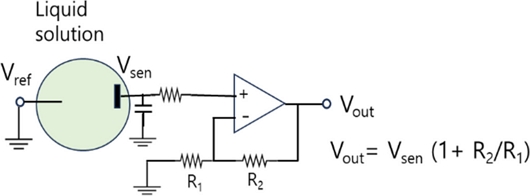
전기화학센서는 센서 전극 표면에서 전하를 띤 입자의 농도를 측정하거나 산화환원반응에 의한 생성물 농도를 측정할 수 있다[29]. 마찬가지로 전계효과트랜지스터(FET) 센서도 게이트 전극 전위 변화 시 반도체 채널의 전기전도성이 변하는 원리를 이용하여 센서 전극으로 전하를 띤 입자 농도를 측정하거나 pH 변화를 검출할 수 있다[4,23,28]. 전기화학센서나 FET센서와 같이 전기 신호 측정방식의 센서 동작원리를 쉽게 이해할 수 있도록 읽기회로(read-out)를 이용하여 설명한다.
Fig. 1은 두 전극 구조의 전기화학센서의 읽기회로(read-out)의 대표적인 예를 보여준다. 검출전극 혹은 센서전극의 전위를 Vsen이라고 표기하였다. 센서전극 표면에서 산화환원반응에 의한 생성물 농도 변화나 용액의 pH 변화가 있으면, Vsen 전위가 변하거나 센싱 전극을 통해 흐르는 전류의 크기가 바뀔 수 있다. 읽기회로의 출력전압 Vout은 Fig. 1에서 나타낸 수식과 같이 표현되므로 전극 센서 표면에서의 센서 전극의 전위 변화는 전기신호변화로 쉽게 읽을 수 있다. 이때 용액의 전위는 Vsen 변화를 측정할 수 있도록 일정해야 하므로 용액은 기준전극의 Vref와도 접촉되어 있어야 한다[17,34]. 기준 전극인 Vref연결 전극으로 전류가 흐를 수 없도록 해야 할 때는 센서 전극(Vsen) 연결은 닫힌 회로(closed circuit)가 되어야 하므로 용액에 카운터 전극이 더 추가될 수 있으며 삼 전극 구조 전기화학센서 회로로 구성된다.
2.2 FET 바이오센서 읽기 회로
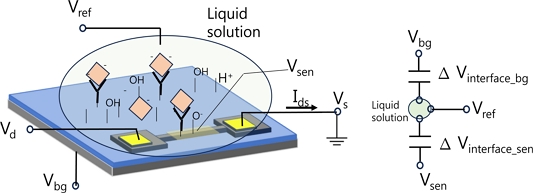
Fig. 2는 FET 바이오센서의 실험 셋업과 읽기 회로 구성을 보여준다. 일반적으로 센서 전극인 게이트 전극만 용액과 접촉해야 하지만, 실제 실험 셋업에서는 Fig. 2(a)처럼 소스/드레인/게이트 전극이나 그 배선(feed line)이 용액과 직접 혹은 절연체를 경계로 간접적으로 접촉한다. 용액전위를 일정하게 유지하기 위해 기준전극 Vref이 사용된다[18]. 타겟 물질 흡착으로 센서 게이트 전극 Vsen의 전위가 바뀌고 전계효과로 반도체 채널의 전도성 변화가 일어나고 Ids 변화를 측정하여 타겟물질 흡착을 분석하는 것이 FET 바이오센서의 동작 메커니즘에 대한 일반적 설명이다. Fig. 2(a)에서처럼 용액 속에서 게이트 전위는 Vsen이며, 용액은 기준전극과 접촉하여 일정한 전위를 유지한다. 용액내 검출 타겟 물질의 농도변화가 있을 경우 기준전극과 용액의 계면(interface surface)에서의 전위변화는 없지만-없어야 한다- 용액과 Vsen 계면에서의 전위 변화가 유발되면 전계효과 동작이 나타나므로 용액내 타겟 물질 농도변화를 분석하는 것이다.
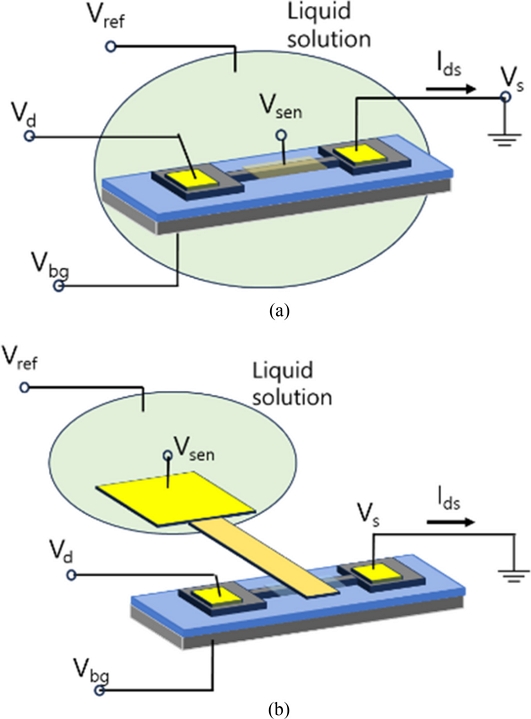
Field-effect transistor biosensor read-out set-up; (a) Device is immersed in the liquid solution (b) Only sensing electrode is exposed to the liquid solution
실제 바이오센서 실험 셋업에서 용액은 소스/드레인 전극 배선이나 바닥게이트 전위인 Vbg와도 직접 접촉하거나 절연막을 통해 접촉하고 있으므로 Vsen의 전위는 FET를 동작시키기 위해 가해주는 소스/드레인 전위나 바닥게이트 전위에 필수불가결하게 영향을 받는다. 왜냐하면 각 전극 배선들은 용액과 접촉하고 있어서 용액의 전위에 직접적으로 영향을 미치거나 pH와 같이 용액내 타겟 농도 변화시 센서 게이트 전극 표면에서 나타나는 것과 동일한 기작으로 경계면 전위 변화가 동시에 유발되므로 용액 전위는 전극 배선 경계면에서 영향을 받을 수밖에 없다[3,4,11,18]. 초기 FET 바이오센서 연구에서는 기준전극 사용에 대한 언급 없이도 실험 결과를 보고하는 사례가 있었는데[4,7,11,14,15], Ids 신호가 별도의 기준전극 없이도 측정될 수 있는 이유는 기판 전위나 전극 배선 전위의 영향이라고 생각할 수 있다[4]. CNT나 그래핀 혹은 나노와이어로 제작한 FET를 동작하기 위해 기판 게이트에 Vbg전압을 가하게 된다[16]. FET 소자가 형성된 기판은 Fig. 2(a)와 같은 실험 셋업에서는 용액과 닿는 것을 피할 수 없으며 바닥 기판 전극의 절연체 표면은 용액과 계면 전위를 형성하여 용액 전위에 영향을 준다[18]. 따라서, 바닥 기판 게이트 전극(Vbg)이 용액의 전위에 영향을 주는 구조이며 바닥 기판 게이트가 용액과 닿는 경계면에서의 전위 변화를 만들어 Ids 신호 변화를 유발할 수 있음을 주목할 필요가 있다.
한편, 좀 더 살펴볼 것은 CNT나 그래핀과 같이 게이트 절연막이 없는 FET 소자의 경우이다. 전극 배선 절연막의 절연 성질이 나쁜 경우 배선 전극과 용액을 통해 게이트 전극이나 반도체 전계효과 채널로 누설 전류가 개입될 수 있으며, 기준전극으로 흐를 수 있는 전류도 센서 게이트나 전극 배선으로 유입되어 Ids 신호로 읽히게 된다.
반도체 파라미터 측정기로 Ids를 측정할 때 소스/드레인/게이트 배선을 통한 누설전류가 포함되면 Ids는 대부분이 전계효과에 의해 유발된 전류변화가 아닌 누설전류에 의한 전류 신호이다. 반도체 파라미터 측정 계측기는 센서소자의 전극면을 접촉하는 신호측정유니트(SMU)의 터미널로 흐르는 전류를 측정하므로 누설전류의 영향은 쉽게 확인이 가능하다. 따라서, FET 센서 측정 실험 셋업시 소스/드레인/게이트/기준전극 등 각 측정 터미널단의 전류를 함께 모니터링 해서 가짜 신호(fake response) 개입 여부와 그 누설 전류의 크기를 동시에 확인해야 한다. 전계효과에 의한 영향이 아닌 용액과 접촉하는 기준전극이나 소자 전극 배선을 통해 흐르는 누설전류가 Ids로 측정될 수 있으므로, 게이트 절연막이 없는 FET 소자로는 Fig. 2(a)와 같은 실험 셋업으로 전계효과를 정확하게 측정하는 것은 사실상 불가능하다는 것을 이해하는 것이 필요하다. 측정에 필요한 소자 동작을 위해 가해주어야 하는 기준전극 전위와 소스/드레인 전극전위차에 의해 용액을 통해 감지전극소재로 누설전류가 흐를 수 밖에 없기 때문이며, Ids 전류의 크기가 Vref 와 소스/드레인 전극 사이의 전위차의 크기에 비례해서 나타나는 특성을 관찰하면 쉽게 측정 셋업 오류를 이해할 수 있다. 예를 들어 Vref=0V, Vbg=0V, Vs=0V, Vd=0.1V를 가해서 Ids 변화 측정을 한다고 가정하면, 기준전극과 센서 게이트 사이에는 0.1V이내의 전위차가 존재하게 되고 용액과 게이트를 통해 누설 전류가 흐르게 되므로 전계효과에 의한 Ids변화를 측정하는 것은 실질적으로 불가능하다.
이러한 우려를 원천적으로 제거할 수 있는 실험 셋업이 Fig. 2(b)이다[17,18]. FET소자는 용액에 닿지 않고 검출전극인 Vsen만 용액에 노출된다. Vsen은 확장게이트(extended gate) 형태로 소자의 게이트 전극과 동일한 전위가 되도록 전기적으로 연결되며, 게이트 절연막으로 게이트 누설전류는 Ids에 비해 매우 작아서 무시할만한 수준이다. 무시할만한 수준이라는 의미는 Ids의 크기에 비해 게이트 누설전류는 매우 작은 값이며 게이트 전위 크기에 가변 되지 않는 특징을 보이지만 게이트 누설전류는 게이트 전위가 커질수록 직접적으로 비례해서 커지는 특성을 보인다. 용액과 접촉하고 있는 Vsen의 전위가 플로팅 전위(floating) 상태가 되면 검출 실험을 할 수 없으므로 용액은 기준전극과 반드시 접촉되어 일정한 전위가 유지되도록 해야 한다[17,18]. 게이트 절연막을 따로 형성하기 어려운 CNT나 그래핀 FET의 경우 바닥게이트 전극인 Vbg를 확장게이트로 사용하여 Fig. 2(b)와 같이 구성할 수 있다고 생각해 볼 수 있다. 한 가지 셋업 가능한 방법의 예를 들면 소자가 만들어진 기판을 뒤집어서 바닥게이트에만 용액이 닿게 하고 용액은 Vref전극과 닿게 하고, 바닥게이트 전위를 Vsen으로 사용하는 방법을 생각해 볼 수 있다. 이 경우에는 CNT나 그래핀 소자에 게이트 바이어스를 별도로 가해줄 수 없어서 나노채널을 turn-on 영역으로 조절할 수 없는 문제가 발생하고[11], 또한 실험 셋업 구조가 사실상 Fig. 1의 전위 센싱 회로와 다를 바가 없으므로 굳이 나노소재 FET를 어렵게 만들어 실험 셋업을 해야 하는 필요성을 찾기 어려워진다.
3. 센서 전극 표면 전위 변화 읽기에 대한 이해와 고찰
3.1 전기화학센서 동작 이해 및 고찰
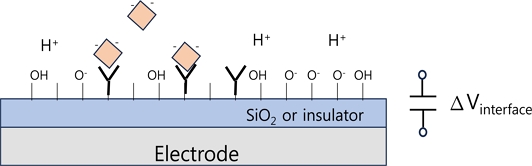
Fig. 1과 같이 전기화학센서에서 센서 전극의 전위 Vsen이 감지물에 의해서 변한다는 설정을 해보자. Fig. 3에 pH농도 변화에 대해 센서 표면을 그림으로 보였다. 예를 들어, 용액의 pH가 변하면 센서 표면의 OH-기능기 분포 변화가 일어나 Vsen 전위가 바뀐다. 읽기회로에서 센서 전극의 전위 변화는 Vout의 변화로 출력되고 이는 pH 변화에 의한 전극 전위 변화 신호이므로 Vout은 pH변화를 출력할 수 있다.
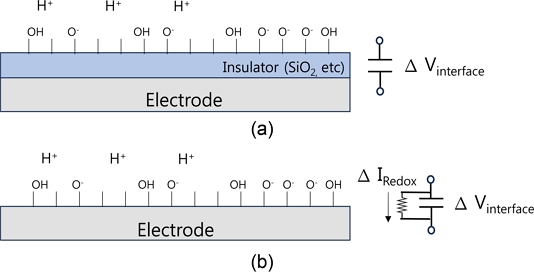
Sensing electrode surface structure in liquid solution; (a) Sensing electrode with insulating layer, (b) Sensing electrode without insulating layer
Fig. 3(a)와 같이 센서 전극에 절연체가 있어서 센서 전극으로 전류가 흐르지 못할 경우 센서 계면 전위 Vsen의 변화를 Fig. 1의 회로 구성으로 Vout을 통해 읽을 수 있으며, pH 변화나 이온농도 변화에 의해 센서 전극의 계면 전위 변화를 검출할 수 있음을 의미한다. 전기화학센서 응용에서는 센서 전극을 통해 흐르는 전류를 측정할 필요가 있으며, Fig. 3(b)와 같이 센서 전극은 직접 용액과 접촉하여 전류가 흐를 수 있도록 구성하는 것이 필요하다[29]. 산화환원반응에 의한 생성물 농도 변화를 센서 전극으로 전자의 이동을 측정하는, 즉 센서 전극을 통해 흐르는 전류를 직접 측정하는 회로 구성도 쉽게 할 수 있다. 전기화학센서의 장점은 두 전극이나 삼 전극으로 구성된 측정 전극 구성을 작은 크기로 모듈화할 수 있고, 센서 전극 표면에 감지 물질을 고정하거나 산화환원반응을 일으키는 반응 기작을 적용하기 위해 센서 전극의 소재나 구조를 간단하게 수정하고 변경할 수 있으며[17], 읽기회로의 변경이 자유롭고, OP앰프 IC 소자 몇개로 구성할 수 있다는 점이다.
3.2 FET 바이오센서 실험 셋업 고찰
이제 Fig. 2(a)와 같은 실험 셋업인 나노소자 FET 바이오센서의 센서 구동원리에 대해 살펴보자. 반도체 채널이나 확장게이트 전극 표면에 고정된 바이오 리셉터가 면역 반응이든 DNA 이중 결합이든 특이적 결합 반응으로 바이오분자를 센서 표면에 흡착시키고, 특이 결합된 바이오분자의 전하가 전계효과를 만들어 나노채널의 전도성 변화를 유도하고 Ids 변화로 감지한다는 것이 일반적 동작 원리에 대한 이해이다.
Fig. 4에 센서 전극 표면 상황을 모식도로 나타내었다. FET바이오센서의 경우 게이트 전극은 전계효과 동작 원리이므로 게이트 절연막을 통과하는 전류는 흘릴 수 없으며 게이트 전극 전위 변화에 의해서만 반도체 채널의 전도성 변화가 일어난다. 게이트 절연막으로 산화막을 사용하게 되면 수소이온 농도 변화에 의해 센서와 용액의 경계면은 OH- 기능기의 변화로 전극 표면 전위 변화가 나타나고 용액과 센서 전극 계면 사이에 걸리는 전위가 달라진다. 게이트 전극의 전위 변화는 반도체 전계효과 채널의 전류변화로 출력될 수 있으며 Ids 측정으로 읽게 된다.
센서 전극 표면에 대해 좀 더 구체적으로 살펴보자. 센서 전극은 금이나 백금 형태의 금속이거나 혹은 Si(OH-)이나 ITO와 같이 전도성 소재일 수 있으며, pH혹은 타겟 바이오분자를 검출하는데 게이트 전극 소재가 어떤 영향이 있을까라는 질문을 할 수 있다[18]. 대부분의 선행 연구는 실리콘 FET 소자는 게이트 전극이 Si/SiO2였고, CNT 그래핀 등의 FET 소자는 탄소가 반도체 채널 소재였음을 상기하자[12-28, 30-37].
선행 연구에서 센서 전극 소재와 pH 반응에 대한 상관관계를 확인하는 실험을 한 것이 있으므로 이를 인용하여 설명한다[18]. pH 변화에 대한 FET 소자의 반응을 보면, 센서 전극의 표면은 용액내 H+이온 농도 변화에 의해 OH-기능기 변화가 유발되고 이로 인해 계면전위 변화가 나타나 Ids 변화가 측정된다. 따라서 pH센서는 Si/SiO2나 ITO처럼 표면 기능기가 OH-구조가 가능한 센서 전극 소재의 경우와 Pt 나 Au처럼 OH-기능기가 형성될 수 없는 소재의 경우로 실험 결과는 나눠진다고 예상할 수 있으며, O- 표면이 있는 금속산화물 전극 소재에서만 pH감응이 크게 읽힌다. 용액의 pH에 따라서 Vsen 전극의 표면은 OH 기능기 변화가 많이 일어나는 소재여야 계면 전위와 연동되는 Vg가 크게 변한다는 예상과 일치한다. pH검출의 경우 H+ 이온에 대해 전극 표면 기능기 변화가 나타나는 소재여야 하므로 ITO나 SiO2와 같은 전극 표면이 pH변화 검출 반응성이 좋다.
금과 같은 금속성 센서 전극으로는 용액의 pH가 변화해도 계면 전위 변화가 작아서 Ids 신호 변화가 나타나지 않는다. 기준 전극을 센싱 전극 소재와 동일한 소재로 사용하여 실험 셋업을 할 경우 표면 전위 변화가 동일하게 나타나며, Vref의 전위 나눔 회로에서 각각 서로 상쇄되어 Vg는 일정하게 되므로 pH 변화가 Vg 변화를 만들지 못한다는 결과도 검출원리 동작 이해에 도움이 된다[18].
바이오분자의 전하가 유도하는 전계효과에 의해 게이트 전극 전위가 바뀌어서 검출된다는 동작원리 가설을 살펴보자[1-28]. 센서 전극 표면에 흡착될 수 있는 바이오분자 양(quantity) 혹은 pH 이온의 양은 전극의 크기에 비례하며 확장게이트 전체 면적에 흡착된 타겟 분자의 양은 게이트 전위를 변화시키는데 기여한다는 논리로 이어진다.
먼저 용액환경이 아닌 공기중에서 동작하는 공기중 전하를 띤 물질 검출용 FET 센서 연구에서는 센서의 전극이 클수록 Ids 변화 기울기가 비례해서 커진다는 실험 결과를 보여줌으로써 표면에 흡착되는 전하를 띤 물질량에 비례해 Ids가 변하는 것을 실험적으로 증명하였다[38-42]. 마찬가지로 용액과 접촉하는 게이트 전극의 면적을 크게 하면 타겟 분자의 양은 전극 면적에 비례해서 많이 흡착하게 되므로 흡착물질 전하의 전계효과 동작원리라면 공기중에서의 FET 동작과 같은 거동을 할 것으로 예상할 수 있다. 확장게이트 형태로 센서 전극의 면적이 매우 큰 소자로 pH센서나 바이오센서로 구성하여 FET 바이오센서의 Ids 변화 크기가 센서 면적과 상관관계가 있는지 확인할 수 있다.
용액에 담긴 센서 전극의 크기와 Ids변화의 크기는 공기중 전하입자를 검출하는 것과 달리 특별한 관계가 없다[18]. 왜냐하면 등가회로에서 파악할 수 있듯이 게이트 전극의 전위는 용액과 접촉한 계면 전극의 전위이며 센서 표면에 흡착되는 타겟 분자 전체 양(total quantity)보다는 용액과 센서 전극 표면 사이 전압 차이 변화에 의한 동작이기 때문이다. 기준 전위 Vref로 유지되는 용액 전위가 게이트 전극 사이인 계면 전압차이 변화에 의해서 Vref 전위가 나눔 값이 달라져 게이트 전위인 Vg가 바뀌는 메커니즘이다[17,18]. 용액-센서 전극 계면 전위차는 흡착되는 물질 전하의 직접적 전계효과로 유발된다고 보기보다 용액과 접촉하는 센서전극 표면의 전기 이중층과 관련되기 때문이다. 좀 더 쉬운 설명으로 흡착되는 바이오 분자가 센서표면 전위 혹은 용액과 센서 전극 사이의 전위차를 바꾸는데 기여하는가에 대한 관점으로 FET 동작 거동을 생각할 수 있다[13,14,19,22]. 즉, Ids 변화는 센서 전극 면적이 더 커서 더 많은 타겟 분자 전하가 흡착하여 그에 비례해서 나타나기보다는 센서 전극 계면 전위가 용액과 접촉하여 바뀌는 메커니즘으로 이해해야 한다[18]. 전해질 용액에서 타겟 바이오분자가 센서 전극에 흡착하여 표면 전위 변화를 유발하는데 기여하는 정도와 전해질 이온과 용액의 수소이온이 센서 전극 표면을 이온화시키는 정도의 차이로 이해하는 것이 합리적이며, 따라서 센서 전극 면적의 함수가 아니라 용액내 센서 전극 표면의 이온화 강도의 함수로 고려되어야 한다는 것이다.
감지 전극의 면적이 클수록 흡착되는 타겟분자의 전체량은 더 많으므로 이들이 만들어내는 전계효과 원리라면 Ids 변화 기울기가 여기에 비례해 커져야 하지만, 실제 동작에서는 센서 전극 면적과 무관하게 용액내 이온을 띤 물질과 작용하여 센서 표면을 이온화 시키는 강도의 변화에 의해서 전위 변화가 나타난다. 따라서 센서 표면에 흡착되는 타겟 바이오분자의 양적 증가가 용액과 접촉하고 있는 센서 전극 표면 전위 변화에 어떻게 기여하는지에 대한 명확한 이해가 중요하다고 할 수 있다.
큰 면적의 센서 전극에서 하나의 바이오분자 흡착 혹은 매우 작은 농도의 바이오분자 흡착이 센서 전극 표면 전위를 바꿀 수 있는가에 대한 관점을 살펴본다. 이는 센서의 검출한계(Limit of detection, LOD)와 검출 가능 동작영역(dynamic range)과 관계된 부분으로 고려될 수 있는 사항이며, 센서 면적이나 센서의 크기와 상관관계가 있는 인자일 것으로 생각되었다[35]. 먼저 하나의 바이오분자를 검출하기에 적합한 조건으로는 센서인 반도체 게이트 채널의 크기가 바이오분자의 크기와 상응하는 상황일수록 이를 검출하는데 적합할 것이라는 직관적 기대가 가능하다[4,35]. 이 가설이 나노FET 연구에 많은 연구자들의 관심을 집중시킨 결정적인 이유였다. 그렇지만 용액의 전위는 기준전극 전위에 의해 일정하게 유지되고 전극 표면의 전위는 결국 용액과 접촉하는 센서 계면을 이온화 시키는 정도에 상관성이 있다는 점을 고려한다면 나노와이어 FET 또한 센서 표면 이온화를 일으키는 수소이온이나 전해질 이온에 의해 영향을 받는다는 점에서 타겟 분자 전하량 자체의 전계효과가 직접적으로 센서 표면 계면 전위 변화로 이어진다고 단정할 수 없고[13,14,19,22], 전해질 농도에 의존하는 바이오분자 전하가 미치는 전계효과 거리의 문제로만 고려하면 센싱 전극 소재와 무관하게 센서 전극에 흡착된 전하를 띤 타겟분자가 Ids 변화를 만들어야하지만 실제 그렇지 않다[4,15,17].
센서의 검출 한계에 대한 논의에 추가하여 센서 전극 면적이 클수록 검출 가능한 타겟 분자 농도 범위가 얼마나 커지는가 하는 문제의식을 검토해 보자. 더 많은 타겟분자를 흡착시킬 수 있는 큰 면적을 갖는 센서일수록 검출반응의 동작영역이 커진다고 기대하는 것이 합리적이지만 이 또한 계면의 전위 변화에 기여해야 Vg가 변화한다는 동작 메커니즘으로 이해해 볼 때 타겟 분자들이 매우 촘촘하게 센서 표면에 흡착되어 표면전위 변화가 최대로 일어나는 크기까지 검출될 수 있을 것이라고 생각할 수 있으므로 전극 면적 그 자체보다는 타겟 바이오 물질의 흡착 밀도와 관련될 수 있는 부분이다[35]. 이 또한 큰 면적의 확장게이트로 연결된 나노 FET 소자의 동작을 생각할 때, 용액 전위로 고정된 확장게이트 표면에 아무리 많은 타겟 바이오분자가 흡착되는 상황이 발생한다고 해도 센서 전극의 표면 기능기가 만들어내는 전위 변화를 능가하는 Ids 변화가 나타나지 않는다는 점에서 타겟 바이오분자가 갖는 전하량에 의한 전계효과 메커니즘이 아니라는 결론에 이른다[17,19].
공기중 이온 검출 실험 셋업은 확장게이트 센서 전극에 유입되는 전하 입자량이 늘어나 Q=CV에 따라 Q에 비례해 V가 계속 커지고, Q의 흡착 속도에 대한 특성도 나타나지만[38-41] 용액 실험에서는 용액을 포함하는 게이트 전체의 공간에 전하를 띤 입자가 추가된다는 것보다 전극과 용액 계면에서 전하입자들의 배치 정도가 바뀔 수 있는 상황이며, 센서 전극 표면 전위 변화를 만드는 양성화/탈양성화(protonation/deprotonation)에 의한 기작일 수밖에 없는 구조이다.
센서 면적과 관련한 검토를 통해 흡착되는 바이오분자 전하의 전계효과가 FET 바이오센서의 직접적 동작원리라고 간주되려면, 타겟 분자 흡착량이 더 많은 더 넓은 면적의 센서 전극 조건일수록 Ids 변화가 더 크게 나타나야 하지만 실제 그렇지 않다. 바이오분자가 띤 전하에 의한 직접적 전계효과가 아니며, 기준 전극으로 전위가 일정하게 유지되는 용액과 센서 전극 사이의 계면에서의 전위 변화에 의해 동작하는 것이므로, 센싱 전극 계면전위 변화를 유발하는 요인이 타겟 바이오분자의 흡착에 의한 것인지에 대한 이해가 핵심이다[18]. 결국 타겟 바이오 분자가 센서 전극 표면에 흡착하여 용액과 전극 계면에서의 전위 변화를 만들어낼 수 있는지에 대한 관점으로 동작 메커니즘 이해를 좁혀 갈 수 있다[4,17,18]. 타겟 분자의 흡착량에 따른 Ids 변화로 해석 가능하려면 흡착농도변화에 따른 Ids 변화 크기가 아니라 흡착이 진행되어 만들어지는 Ids 변화의 기울기 함수여야 하지만 이를 주목한 연구는 거의 없다[2-4,7,14,17,39].
용액과 접촉하고 있는 센서 전극표면 전위 변화가 pH 변화나 전해질 이온농도 변화에 의한 것과 타겟 바이오분자의 특이 흡착에 의한 것이 서로 구분될 수 있을까라는 관점으로 FET 바이오센서의 동작원리를 고려해 보자. 즉, 센서 표면에 고정된 리셉터에 의해 특이하게 흡착되는 바이오분자의 양적 변화에 의해 유발될 수 있는 계면 전위 변화와 버퍼 용액의 기본 환경 인자인 pH 농도와 버퍼용액을 구성하는 이온들의 농도가 만들어내는 전극 계면전위 변화가 구분될 수 있느냐에 대한 부분이다.
pH 환경조건과 전해질에서의 이온농도는 타겟 바이오분자의 전하가 용액내에서 전계효과를 미치는 거리에도 영향을 주며[14], 마찬가지로 센서 전극 표면 전위가 용액에 미치는 거리에도 영향을 준다. FET 바이오센서는 센서의 표면전위가 타겟분자 흡착이 아닌 pH나 전해질 이온들에 의해서는 바뀌면 안되므로 일정하게 유지시켜야 하며, 타겟 분자 검출 실험을 위해 타겟 분자가 포함된 검출대상 용액을 센서 표면으로 투입해야 한다. 센서가 측정해야 하는 환자 시료별로 혹은 검체 시료별로 pH조건이나 전해질 이온 농도는 일정하지 않으므로 센서의 초기 조건 설정이 매우 어렵거나 불가능하며 실시간 타겟 분자 검출이라는 동작 실험은 용액 환경 변화가 동시에 발생하므로 처음부터 불가능하다[15]. pH와 이온농도에 의해서 전극 계면 전위가 바뀌지 않도록 일정하게 유지하면서 환자 시료내 타겟 분자만 센서 전극 표면으로 유입되도록 해야 하는데 이러한 상황 연출은 사실상 가능하지 않다. 센서의 초기상태를 결정하는 기준이 되는 용액 환경을 그대로 유지하면서 타겟 분자만 센서에 넣어주는 환경 조건을 만들 수 없기 때문이다. 예를 들어 검출 타겟 분자에 대한 FET 바이오센서의 농도별 반응 실험을 하기 위해 기준 농도 용액을 버퍼 용액과 의도한 비율로 혼합하여 시료를 준비하게 되는데 타겟 단백질 농도만 희석되는 것이 아니라 그 검사 용액의 환경 인자들도 섞는 비율에 비례해 희석된다. 그러므로 실시간으로 타겟 바이오분자의 흡착을 검출할 수 있다는 연구방법은 현실적으로는 활용될 수 없다[2,4].
실시간 흡착 검출이 아닌 방법으로 기준이 되는 버퍼용액에서 센서의 초기 상태를 확인하고 검체 용액을 투입하여 타겟 분자를 센서 전극 표면에 결합반응 시킨 후 버퍼 용액으로 센서를 세척하여 센서의 버퍼 용액 환경을 처음 상태와 동일하게 돌려놓는 전략으로 Ids 변화를 분석하는 방법을 고려해 볼 수 있다[15]. 실시간 타겟분자 검출 실험 결과를 제시했던 여러 논문들의 결과를 보면 세척 후 버퍼용액 환경에서 처음 Ids 값으로 돌아오는 것을 보여주는데 그 이유를 타겟 분자가 세척되어 리셉터로부터 떨어져 나간 것이 그 이유라고 설명하고 있으나 실제 면역 반응은 버퍼용액 환경에서는 가역적이지 않으므로 가짜 신호에 의한 오류라고 볼 수 있다[2,4,14]. 동일한 용액 환경 조건에서 타겟 분자의 흡착 반응 전후 Ids변화를 비교하는 실험 방식은 전기식 센서의 변화 현상(drift)에 의한 Ids 변화가 있으므로 쉽지 않다. pH용액을 반복해서 바꾸기만 해도 Ids의 값은 처음 값과 달리 드리프트(drift)에 의해 바뀌기 때문이다[18]. 동일 버퍼 환경으로 되돌리더라도 Ids 초기 상태의 값으로 유지하기 어려운 특성이 나타난다는 의미이며, 이 때문에 타겟 분자의 흡착에 의한 표면 전위 변화에 의한 것인지 센서의 드리프트의 결과인지 구분하기 어렵고, 나노FET 바이오센서가 검출한계가 우수하다는 센서의 장점을 실현하는 데는 더욱 어려운 상황이 된다.
일반적으로 나노소자 FET 바이오센서는 Fig. 2(a)의 구조에서 보듯이 게이트 전극의 크기가 매우 작다. 나노와이어 FET 바이오센서의 예를 들면 직경이 20nm 크기에 소스/드레인간 거리가 10㎛라고 가정하면 면적이 20nm × 20nm × 10㎛에 불과하다. 하지만 소자가 형성되어 있는 기판은 대략 수~수십 mm 크기이므로 화학기능기의 변화와 타겟분자의 흡착 이벤트는 기판 전극 절연체 표면에서 일어나는 것이 더 지배적이다. CNT나 그래핀 등은 탄소 결합에 기반을 둔 화학기능기 말단 구조가 되고, 실리콘 소자의 경우 기판 절연체가 SiO2인 경우 표면 기능기는 동일한 소재이므로 게이트 전극 표면이든 기판 절연체 표면이든 동일한 타겟 흡착 반응이 일어날 수밖에 없다. 많은 논문들이 용액의 타겟 분자 농도를 달리하면서 Vbg 전압을 바꿔가며(sweep) Ids를 측정하는 실험 결과로 얻은 나노 소자의 IV 커브 데이터를 정량 검출 가능성의 근거로 해석했다[16]. 문턱전압이 이동(shift)하는 정도 혹은 탄소 소자의 디락(Dirac) 전위 위치가 이동하는 정도가 정량 검출과 관계가 있다고 생각한 것이다[16]. 그러나 Fig. 5와 같은 상황이 전개되므로 타겟 분자의 농도가 바뀌거나 타겟 분자의 농도를 바꾸기 위해 같이 동반되는 버퍼 용액 바뀜에 의해 기판의 절연체 표면에서도 용액과 접촉된 계면에서 표면 전위 변화가 일어나게 된다. Fig. 5의 등가회로에서 이를 표현하였다. 가변 커패시터 (capacitor)는 계면의 전위 변화를 나타내기 위해 편의적으로 사용한 것이며 기준전극 계면 전위는 가변되지않는다고 가정하여 일정한 커패시터로 나타내었다[17,18].
Sensing electrode of FET biosensor; The Sensing electrode is the gate electrode or the extended gate. Note that the surface potential Vg would be varied by the voltage difference in the inter face layer between the l iquid solution and the electrode surface resulting from the voltage division of Vref applied to the liquid solution. In the equivalent circuit, the potential difference in the interface layer is represented with a capacitor to illustrate the surface potential variation of the electrode interfacing with the liquid[17].
타겟분자가 흡착할 수 있는 확률적 측면에서 센서 표면 자체에서의 흡착량보다는 면적이 훨씬 넓은 기판 전극 절연체 표면에서의 흡착되는 타겟분자가 많고 표면 화학 기능기 변화도 수반되므로 전극 계면 전위는 같이 바뀌는 결과가 나타나며 이 때문에 게이트 전위인 Vsen이 영향을 받을 수 있어서 게이트 전위가 바뀔 수 있다. Ids 신호 변화는 센서 표면 자체에서의 타겟 분자 흡착뿐만 아니라 주변의 기판 표면에서 일어나는 타겟 전하물질 흡착에 의해서도 회로적으로 읽힐 수 있다는 것을 보여준다[18]. 물론, 이런 해석 또한 게이트를 통한 누설전류에 의한 영향을 배제할 수 있어야만 고려될 수 있음을 상기할 필요가 있다.
정리하자면 타겟 바이오분자를 나노FET 소자로 검출할 수 있다는 것을 보여주기 위해 실험결과를 제시했던 많은 연구들은 검출 실험 셋업에서 가짜 신호가 쉽게 개입될 수 있음을 확인하지 않았고 용액 전위가 유지되는 조건에서 전계효과 동작원리 메커니즘을 명확하게 이해하지 못하고 연구했다는 것을 지적한다. 센서 전극인 게이트 영역 자체는 절연막이 없는 CNT, 그래핀 FET 소자의 경우 소자를 동작시키기 위해 가해주는 배선 전위나 기준전극 전위와의 차이에 의해 만들어지는 누설 전류가 Ids로 개입될 수밖에 없어서 측정 신호 자체가 누설전류에 의한 것이므로 Ids 변화를 측정하고 이를 해석하는 것은 무의미하다. CNT게이트로 전류가 흐르는 상태로 타겟 분자 농도와의 상관관계를 실험할 수도 있다는 생각은 전기화학센서에서 센서 전극을 CNT로 구성하는 것과 다름아니며 더 이상 전계효과 동작원리 센서가 아니게 된다. 절연막이 있는 실리콘 FET 센서의 경우 게이트 전극으로의 누설전류가 없다고 하더라도 바닥 기판이 용액과 닿게 되므로 Vbg 전위가 용액의 전위에 영향을 주게 되고 pH 변화 등 타겟 분자의 농도 변화가 발생하면 센서 전극표면 그 자체에서뿐만 아니라 바닥기판 표면에서의 용액 경계면에서도 동시에 계면 전위 변화가 발생하여 용액의 전위가 영향을 받으므로 결과적으로 게이트 전위 변화를 일으킬 수 있게 되므로, 센서 전극 표면에서만의 타겟 특이적 결합으로 Ids 신호가 나타난다고 확정할 수 없다. 타겟 분자 전하의 직접적 전계효과에 의해 FET 센서가 동작한다는 가설이 수정되어야 함을 시사한다. 확장 게이트 구조를 이용한 FET 바이오센서 동작 원리를 보여주는 선행 연구에서 이러한 내용을 명확하게 이해시켜준다[17,18].
명확하게 이해할 수 있는 사실은 FET 바이오센서는 용액내 타겟 분자가 센서 전극에 흡착되는 절대량에 의한 것이 아니라 용액과 전극 계면의 전위 변화에 의해 채널 전도도가 나타난다는 것이다. FET 바이오센서의 응용 연구가 필요하고 유용하다는 기존 연구 논문들이 제시한 결과에서 가짜 신호의 개입이 배제될 수 있고 바이오분자의 흡착 전하가 용액의 수소이온 농도 변화가 유발하는 전극 표면 전위 변화와 구분되어 나타날 수 있음을 보이는 것이 중요하다는 것을 시사한다. FET를 이용한 바이오센서가 기대를 모으게 했던 장점인 센서 소자의 저가격 가능성과 전위 검출 원리의 간편성이 센서 연구의 필요성이라면 Fig. 1에서 보여주는 전기화학센서의 표면 전위 읽기회로 구성으로도 의도한 센서의 장점을 얻을 수 있을 것으로 생각한다[17]. 센서 표면 전위를 측정하는 센서는 FET 집적회로로 구성된 OP앰프 회로로도 구성할 수 있기 때문이다. FET 바이오센서 실험 셋업에 근원적으로 내재된 가짜 반응(fake response)신호에 대한 우려 없이 훨씬 저렴하고 간단한 센싱 셋업으로 쉽게 전위 변화를 측정하면서 pH에 의한 영향인지 바이오분자 흡착에 의한 것인지 이 두 요인을 서로 구분할 수 있을 것인지를 증명하는 실험을 설계하고 검증하기가 더 수월하기 때문이다.
전위 변화 측정방식과 좀 다른 원리이긴 하지만 전기화학센서 연구에서 바이오센서는 산화환원반응 생성물의 농도를 측정함에 있어서 검출 한계를 극복하는 것이 중요한데, 이를 위해서는 전극을 통한 전자교환 특성이 필수적이라 전극 표면에 화학기능기 도입을 직접적으로 하지 않는 것이 높은 감도 구현에 도움이 된다는 것도 짚어 둔다[29].
4. 결 론
전기신호 측정원리의 바이오센서인 전기화학센서와 FET 센서의 동작원리를 읽기회로 실험 셋업을 이용하여 몇 가지 동작 메커니즘 사례를 들어 설명했다. FET 소자의 전계효과 원리에 의한 동작은 전기화학센서 읽기회로로도 확인이 가능하며, 상용화된 OP앰프 IC소자를 사용하여 회로를 구성할 수 있으므로 제작하는 데 많은 시간과 자원을 투입해야하는 나노소재 FET 소자를 바이오센싱 응용에 직접 적용하려는 노력보다는 본 연구에서 예로 든 읽기회로를 응용하여 전기식 센서의 동작 원리를 명확히 이해할 수 있는 실험 셋업으로 먼저 확인해보는 것이 도움이 될 것으로 생각한다.
지금까지 보고된 FET 바이오센서의 실험 셋업에서 나타날 수 있는 가짜 신호를 유발하는 요인과 잘못된 신호를 읽을 수밖에 없는 이유를 설명했다. 용액에 노출되는 센서 소자의 전극 배선과 기준전극을 통해 게이트 전극으로 누설 전류가 유입되어 흐르게 되면 이는 모두 Ids변화로 읽히게 되므로 Ids변화는 가짜 신호일 수밖에 없다. 게이트 절연막이 있는 확장게이트 구조의 셋업으로 이러한 문제점을 해소한 실험 셋업으로 전계효과 동작원리를 좀 더 구체적으로 분석하여 설명하였다. 전극에 흡착되는 타겟분자의 전하량 총량에 의해서 Ids가 변하는 것이 아니라 용액과 전극 표면사이 계면전위 변화에 의해서 Ids가 변한다는 관점으로 동작 메커니즘을 고려해야 하며, 전계효과원리에 주목하려면 공기중 이온검출실험 결과와 같이 타겟 농도 변화에 대해 Ids는 기울기 변화 거동을 보이며, 흡착량 포화 레벨에 도달하는 소요시간함수로 나타날 것이란 기대가 가능하다.
센서 전극 표면에 타겟 분자의 흡착이 일어나더라도 계면전위 변화에 기여하지 못하면 FET 바이오센서로는 타겟 분자를 검출할 없다는 결론에 이른다. 버퍼용액의 pH와 이온농도에 의해 기본적으로 센서 전극의 계면 전위가 주요하게 영향을 받으므로, 용액환경인자들의 개입과 분리하여 타겟 바이오분자 흡착 요인에 의한 게이트 전위 변화 검출은 현실적으로는 어려울 것으로 생각된다. 전해질 용액내 타 인자가 유발하는 감지전극 표면의 OH 기능기 변화보다 더 우세하게 단분자 흡착(single molecule)이 센서 전극 계면 전위를 바꿔줄 수 있는 요인이 될 수 있어야 바이오분자 검출 동작을 기대할 수 있다. 전극 표면 전위는 용액에 내재된 수소이온들이나 전해질 이온들에 의해 양극화/탈양극화 (protonation/deprotonation) 정도의 크기로 좌우되는 현상이다.
센서에 흡착되는 바이오분자가 pH의 영향보다 더 우세하게 용액과 전극 계면 사이의 전위 변화에 기여하고, 그 영향이 pH 농도나 전해질 이온농도 변화가 유발시키는 것과 구분될 수 있다는 것을 명확하게 증명하기 전에는 기존 연구들이 주장했던 전계효과 바이오센서 동작원리 가설은 성급했던 것으로 보인다.
REFERENCES
-
M. J. Schöning and A. Poghossian, “Recent advances in biologically sensitive field-effect transistor(BioFETs)”, Analyst, Vol. 127, No. 9, pp. 1137-1151, 2002.
[https://doi.org/10.1039/B204444G]

-
X. Duan, Y. Li, N. K. Rajan, D. A. Routenberg, Y. Modis, and M. A. Reed, “Quantification of the affinities and kinetics of protein interactions using silicon nanowire biosensors”, Nat. Nanotechnol., Vol. 7, No. 6, pp. 401-407, 2012.
[https://doi.org/10.1038/nnano.2012.82]

-
E. Stern, A. Vacic, N. K. Rajan, J. M. Criscione, J. Park, B. R. Ilic, D. J. Mooney, M. A. Reed, and T. M. Fahmy, “Label-free biomarker detection from whole blood”, Nat. Nanotechnol., Vol. 5, No. 2, pp. 138-142, 2010.
[https://doi.org/10.1038/nnano.2009.353]

-
E. Stern, A. Vacic, and M. A. Reed, “Semiconducting nanowire field-effect transistor biomolecular sensors”, IEEE Trans. Electron Devices, Vol. 55, No. 11, pp. 3119-3130, 2008.
[https://doi.org/10.1109/TED.2008.2005168]

-
A. Poghossian and M. J. Schöning, “Label-free sensing of biomolecules with field-effect devices for clinical applications”, Electroanalysis, Vol. 26, No. 6, pp. 1197-1213, 2014.
[https://doi.org/10.1002/elan.201400073]

-
A. J. Qavi, A. L. Washburn, J. Y. Byeon, and R. C. Bailey, “Label-free technologies for quantitative muliparameter biological analysis”, Anal. Bioanal. Chem., Vol. 394, No. 1, pp. 121-135, 2009.
[https://doi.org/10.1007/s00216-009-2637-8]

-
A. Vacic, J. M. Criscione, E. Stern, N. K. Rajan, T. Fahmy, and M. A. Reed, “Muliplexed SOI BioFETs”, Biosens. Bioelectron., Vol. 28, No. 1, pp. 239-242, 2001.
[https://doi.org/10.1016/j.bios.2011.07.025]

-
S. Gupta, M. Elias, X. Wen, J. Shapiro, L. Brillson, W. Lu, and S. C. Lee, “Detection of clinically relevant levels of protein analyte under physiologic buffer using planar field effect transistors”, Biosens. Bioelectron., Vol. 24, No. 4, pp. 505-511, 2008.
[https://doi.org/10.1016/j.bios.2008.05.011]

-
A. Star, J. C. P. Gabriel, K. Bradley, and G. Grüner, “Electronic detection of specific protein binding using nanotube FET devices”, Nano Lett., Vol. 3, pp. 459-463, 2003.
[https://doi.org/10.1021/nl0340172]

-
C. S. Lee, S. K. Kim, and M. Kim, “Ion-sensitive field-effect transistor for biological sensing”, Sensors, Vol. 9, No. 9, pp. 7111-7131, 2009.
[https://doi.org/10.3390/s90907111]

-
X. P. A. Gao, G. Zheng, and C. M. Lieber, “Subthreshold regime has the optimal sensitivity for nanowire FET biosensors”, Nano Lett., Vol. 10, No. 2, pp. 547-552, 2010.
[https://doi.org/10.1021/nl9034219]

-
M. Y. Shen, B. R. Li, and Y. K. Li, “Silicon nanowire field-effect-transistor based biosensors: from sensitive to ultra-sensitive”, Biosens. Bioelectron., Vol. 60, pp. 101-111, 2014.
[https://doi.org/10.1016/j.bios.2014.03.057]

-
P. R. Nair and M. A. Alam, “Design Considerations of Silicon Nanowire Biosensors”, IEEE Trans. Electron Devices, Vol. 54, No. 12, pp. 3400-3408, 2007.
[https://doi.org/10.1109/TED.2007.909059]

-
E. Stern, R. Wagner, F. J. Sigworth, R. Breaker, T. M. Fahmy, and M. A. Reed, “Importance of the Debye screening length on nanowire field effect transistor sensors”, Nano Lett., Vol. 7, No. 11, pp. 3405-3409, 2007.
[https://doi.org/10.1021/nl071792z]

-
A. Kim, C. S. Ah, C. W. Park, J.-H. Yang, T. Kim, C.-G. Ahn, S. H. Park, and G. Y. Sung, “Direct label-free electrical immunodetection in human serum using a flow-through-apparatus approach with integrated field-effect transistors”, Biosens. Bioelectron., Vol. 25, No. 7, pp. 1767-1773, 2010.
[https://doi.org/10.1016/j.bios.2009.12.026]

-
B. Cai, S. Wang, L. Huang, Y. Ning, Z. Zhang, G. J. Zhang, “Ultrasensitive label-free detection of pna–dna hybridization by reduced graphene oxide field-effect transistor biosensor”, ACS Nano, Vol. 8, No. 3, pp. 2632-2638, 2014.
[https://doi.org/10.1021/nn4063424]

-
M. Kaisti, A. Kerko, E. Aarikka, P. Saviranta, Z. Boeva, T. Soukka, and A. Lehmusvuori, “Real-time wash-free detection of unlabeled PNA DNA hybridization using discrete FET sensor”, Sci. Rep., Vol. 7, No. 1, pp. 15734(1)-5734(8), 2017.
[https://doi.org/10.1038/s41598-017-16028-7]

-
H.-L. Kang, S. Yoon, D.-k. Hong, S. Song, Y. J. Kim, W.-H. Kim, W.-K. Seong, and K.-N. Lee, “Verification of Operating Principle of Nano Field-effect Transistor Biosensor with an Extended Gate Electrode”, BioChip J., Vol. 14, pp. 381-389, 2020.
[https://doi.org/10.1007/s13206-020-4410-1]

-
P. R. Nair and M. A. Alam, “Screening-limited response of nanobiosensors”, Nano Lett., Vol. 8, No. 5, pp. 1281-1285, 2008.
[https://doi.org/10.1021/nl072593i]

-
K. I. Chen, B. R. Li, and Y. T. Chen, “Silicon nanowire field-effect transistor-based biosensors for biomedical diagnosis and cellular recording investigation”, Nano Today, Vol. 6, No. 2, pp. 131-154, 2011.
[https://doi.org/10.1016/j.nantod.2011.02.001]

-
V. Pachauri and S. Ingebrandt, “Biologically sensitive field-effect transistors: from ISFET to NanoFETs”, Essays Biochem., Vol. 60, pp. 81-90, 2016.
[https://doi.org/10.1042/EBC20150009]

-
M. Kaisti, “Detection principles of biological and chemical FET sensors”, Biosens. Bioelectron., Vol. 98, pp. 437-448, 2017.
[https://doi.org/10.1016/j.bios.2017.07.010]

-
B. M. Lowe, K. Sun, I. Zeimpekis, C. K. Skylaris, and N. G. Green, “Field-effect sensors - from pH sensing to biosensing: sensitivity enhancement using streptavidin-biotin as a model system”, Analyst, Vol. 142, pp. 4173-4200, 2017.
[https://doi.org/10.1039/C7AN00455A]

-
C. A. Vu and W. Y. Chen, “Field-effect transistor biosensors for biomedical applications: recent advances and future prospects”, Sensors, Vol. 19, No. 19, pp. 4214(1)-4214(22), 2019.
[https://doi.org/10.3390/s19194214]

-
W. Guan, X. Duan, and M. A. Reed, “Highly specific and sensitive non-enzymatic determination of uric acid in serum and urine by extended gate field effect transistor sensors”, Biosens. Bioelectron., Vol. 51, pp. 225-231, 2014.
[https://doi.org/10.1016/j.bios.2013.07.061]

-
T. Minamiki, T. Minami, R. Kurita, O. Niwa, S. Wakida, K. Fukuda, D. Kumaki, and S. Tokito, “A label-free immunosensor for IgG based on an extended-gate type organic field effect transistor”, Materials, Vol. 7, No. 9, pp. 6843-6852, 2014.
[https://doi.org/10.3390/ma7096843]

-
T. Goda and Y. Miyahara, “Label-free and reagent-less protein biosensing using aptamer-modified extended-gate field-effect transistor”, Biosens. Bioelectron., Vol. 45, pp. 89-94, 2013.
[https://doi.org/10.1016/j.bios.2013.01.053]

-
Y.-L. Chin, J.-C. Chou, T.-P. Sun, H.-K. Liao, W.-Y. Chung, and S.-K. Hsiung, “A novel SnO2/Al discrete gate ISFET pH sensor with CMOS standard process”, Sens. Actuators B, Vol. 75, No. 1-2, pp. 36-42, 2001.
[https://doi.org/10.1016/S0925-4005(00)00739-5]

-
S. Song, Y. J. Kim, H. L. Kang, S. Yoon, D. K. Hong, W. H. Kim, I. S. Shin, W. K. Seong, and K. N. Lee, “Sensitivity Improvement in Electrochemical Immunoassays Using Antibody Immobilized Magnetic Nanoparticles with a Clean ITO Working Electrode”, BioChip J., Vol. 14, pp. 308-316, 2020.
[https://doi.org/10.1007/s13206-020-4309-x]

-
L.-T. Yin, J.-C. Chou, W.-Y. Chung, T.-P. Sun, and S.-K. Hsiung, “Study of indium tin oxide thin film for separative extended gate ISFET”, Mater. Chem. Phys., Vol. 70, No. 1, pp. 12-16, 2001.
[https://doi.org/10.1016/S0254-0584(00)00373-4]

-
T. N. T. Nguyen, Y. G. Seol, and N. E. Lee, “Organic field-effect transistor with extended indium tin oxide gate structure for selective pH sensing”, Org. Electron., Vol. 12, No. 11, pp. 1815-1821, 2011.
[https://doi.org/10.1016/j.orgel.2011.07.009]

-
B. Reddy, B. R. Dorvel, J. Go, P. R. Nair, O. H. Elibol, G. M. Credo, J. S. Daniels, E. K. C. Chow, X. Su, M. Varma, M. A. Alam, and R. Bashir, “High-k dielectric Al2O3 nanowire and nanoplate field effect sensors for improved pH sensing”, Biomed. Microdevices, Vol. 13, pp. 335-344 2011.
[https://doi.org/10.1007/s10544-010-9497-z]

-
P. D. Batista and M. Mulato, “ZnO extended-gate field-effect transistor as pH sensors”, Appl. Phys. Lett., Vol. 87, No. 14, p. 143508, 2005.
[https://doi.org/10.1063/1.2084319]

-
E. D. Minot, A. M. Janssens, I. Heller, H. A. Heering, C. Dekker, and S. G. Lemay, “Carbon nanotube biosensors: The critical role of the reference electrode”, Appl. Phys. Lett., Vol. 91, No. 9, p. 093507, 2007.
[https://doi.org/10.1063/1.2775090]

-
F.-S. Zhou and Q.-H. Wei, “Scaling laws for nanoFET sensors”, Nanotechnology, Vol. 19, No. 1, pp. 015504(1)-015504(6), 2008.
[https://doi.org/10.1088/0957-4484/19/01/015504]

-
A. Das, D. H. Ko, C.-H. Chen, L.-B. Chang, C.-S. Lai, F.-C. Chu, L. Chow, and R.-M. Lin, “Highly sensitive palladium oxide thin film extended gate FETs as pH sensor”, Sens. Actuators B, Vol. 205, pp. 199-205, 2014.
[https://doi.org/10.1016/j.snb.2014.08.057]

-
K. Suna, I. Zeimpekisa, C. Hua, N. M. J. Ditshegoa, O. Thomasb, M. R. R. de Planquea, H. M. H. Chonga, H. Morgana, and P. Ashburna, “Effect of subthreshold slope on the sensitivity of nanoribbon sensors”, Nanotechnology, Vol. 27, pp. 285501(1)-285501(9), 2016.
[https://doi.org/10.1088/0957-4484/27/28/285501]

-
Y. T. Seo, K. N. Lee, K. J. Jang, M. H. Lee, H. S. Lee, W. K. Seong, and Y. K Kim, “Negative ions detection in air using nano field-effect-transistor (nanoFET)”, Micro Nano Sys. Lett., Vol. 2, pp. 1-6, 2014.
[https://doi.org/10.1186/s40486-014-0007-6]

-
K.-N. Lee, Y.-T. Seo, Y.-K. Kim, S. Yoon, M.-H. Lee, and W. Seong, “Detection ions in air using a nano field-effect transistor (nanoFET)”, Microelectron. Eng., Vol. 158, pp. 75-79, 2016.
[https://doi.org/10.1016/j.mee.2016.03.032]

-
H. L. Kang, S. Yoon, D. K. Hong, W. H. Kim, W. K. Seong, and K. N. Lee, “Ion balance detection using nano field-effect transistor with an extended gate electrode”, Micro and Nano Syst. Lett., Vol. 8, No. 1, pp. 1-6, 2020.
[https://doi.org/10.1186/s40486-020-00106-z]

-
K.-N. Lee, Y.-T. Seo, S. Yoon, M.-H. Lee, Y.-K. Kim, and W. Seong, “Chemical gating experiment of a nano-field-effect transistor sensor using the detection of negative ions in air”, Sens. Actuators B, Vol. 236, pp. 654-658, 2016.
[https://doi.org/10.1016/j.snb.2016.06.057]

-
H.-L. Kang, S. Yoon, D.-K. Hong, W.-H. Kim, W. K. Seong, and K.-N. Lee, “I-V hysteresis characteristics of nano-field effect transistor (nanoFET) sensor with a floating metal gate electrode”, Microelectron. Eng., Vol. 213, pp. 35-40, 2019.
[https://doi.org/10.1016/j.mee.2019.04.014]